Farmacopeea de Stat a Federației Ruse, ediția a XII-a. Determinarea principalelor grupe de substanțe biologic active
Medicamentele sunt un produs de producție specific, a cărui calitate nu poate fi evaluată de consumator de unul singur. Asigurarea calității medicamentelor produse atât în Rusia, cât și importate din străinătate este una dintre principalele sarcini ale statului în domeniul protecției sănătății publice. Printre cele mai importante sarcini ar trebui atribuite nu numai saturarea propriei noastre piețe farmaceutice cu aceste medicamente, ci și intrarea pe piața farmaceutică internațională, care poate fi realizată asigurându-se că medicamentele domestice îndeplinesc cerințele standardelor mondiale, - discursul de deschidere al ministrului Veronica Skvortsova la publicație.
Noua ediție a Farmacopeei de Stat din ediția a XIII-a rezolvă aceste sarcini strategice.
Prima farmacopee, publicată în 1765, era în limba latină și avea scopul de a asigura calitatea medicamentelor utilizate de chirurgi în spitalele militare. În anii următori, decenii și secole, farmacopeea internă a fost republicată în mod repetat, actualizându-și conținutul în conformitate cu starea și nivelul de dezvoltare al industriei farmaceutice și sistemul de control și licențiere atât în țara noastră, cât și în străinătate, - a spus în introducere directorul Departamentului de Stat pentru reglementarea circulației medicamentelor fondurile Arsalan Tsyndymeev.
Farmacopeea de stat a ediției a XIII-a include 229 de monografii generale și 179 de monografii.
Pentru prima dată, 99 de articole farmacopee generale sunt introduse în Farmacopeea de Stat a ediției a XIII-a, dintre care 30 sunt pentru metode de analiză, 5 pentru forme de dozare și 12 pentru metode pentru determinarea indicatorilor farmaceutici și tehnologici ai formelor de dozare. În plus, 2 monografii farmacopee generale - pentru materii prime de plante medicinale și 3 - pentru metode de analiză a acesteia, 7 - pentru grupuri de medicamente imunobiologice și 31 - pentru metode de testare a acestora, 3 - pentru grupuri de medicamente din sânge și plasmă umană și sânge de animale, 9 - pe metode de analiză a medicamentelor obținute din sânge și plasma sanguină a oamenilor și animalelor.
Principalul obiectiv urmărit de Farmacopeea de Stat a Federației Ruse este de a standardiza calitatea medicamentelor aflate în circulație pe piața farmaceutică internă ”, notează Elena Sakanyan, directorul Centrului pentru Farmacopee și Cooperare Internațională al„ NCESMP ”al FSBI.
Eliberarea în timp util a Farmacopeei de Stat a Federației Ruse, care, în conformitate cu Legea federală „Cu privire la circulația medicamentelor”, ar trebui efectuată cu o frecvență care nu depășește 1 dată în 5 ani, va fi cheia pentru rezolvarea problemei de a oferi asistență medicală de înaltă calitate acordată populației din țara noastră.
Ordinul Ministerului Sănătății al Federației Ruse nr. 771 din 29 octombrie 2015 prevede introducerea monografiilor generale și a monografiilor incluse în Farmacopeea de Stat a ediției a XIII-a de la 1 ianuarie 2016.
S-a stabilit că monografiile generale și monografiile aprobate prin acest ordin, monografiile generale și monografiile aprobate prin ordin al Ministerului Sănătății al Federației Ruse din 21 noiembrie 2014 nr. 768 „Cu privire la aprobarea monografiilor și monografiilor generale” constituie statul Farmacopeea XIII ediții.
Am stabilit că:
documentația de reglementare pentru medicamentele înregistrate de uz medical, precum și pentru medicamentele de uz medical, ale căror cereri de înregistrare de stat sunt depuse la Ministerul Sănătății al Federației Ruse înainte de introducerea monografiilor farmacopee aprobate prin prezentul ordin. să fie adus în conformitate cu aceste monografii înainte de 1 ianuarie 2018;
documentația de reglementare pentru medicamentele înregistrate de uz medical, precum și medicamentele de uz medical, ale căror cereri de înregistrare de stat sunt depuse la Ministerul Sănătății al Federației Ruse înainte de introducerea monografiilor generale farmacopee aprobate prin acest ordin, este sub rezerva armonizării cu aceste articole generale de farmacopee înainte de 1 ianuarie 2019.
Noua farmacopee de stat poate fi găsită la adresa de e-mail:
O caracteristică a etapei actuale de standardizare a medicamentelor este necesitatea de a armoniza cerințele privind calitatea medicamentelor și metodele de testare a acestora, impuse de Farmacopeea rusă și de farmacopeile străine de conducere.
A XII-a ediție a Farmacopeei de Stat a Federației Ruse va cuprinde cinci părți.
Prima parte descrie dispozițiile generale, metodele de analiză, cerințele pentru substanțele farmaceutice și monografiile farmacopeei referitoare la substanță.
Farmacopeea de Stat (GF) este o colecție de standarde de bază utilizate în analiza și producția de medicamente farmacopee. Farmacopeea de stat are un caracter legislativ. Farmacopeea de stat se bazează pe monografii generale farmacopeice (OFS) și monografii farmacopeice (FS). OFS descrie dispozițiile generale, metodele de analiză adoptate în analiza farmacopeică sau include o listă de indicatori standardizați și metode de testare pentru o anumită formă de dozare. FS determină nivelul cerințelor pentru anumite medicamente.
CONŢINUT
I. COMITETUL DE REDACȚIE AL ROSZDRAVNADZOR PRIVIND ORGANIZAREA LUCRĂRILOR PE FARMACOPEIA DE STAT 7
II. PREFAȚĂ 9
III. ORGANIZAȚII, INSTITUȚIILE RUSIEI ȘI SPECIALISTI CARE PARTICIPĂ LA PREGĂTIREA PARTII 1 A FARMACOPEIEI DE STAT A FEDERAȚIEI RUSII EDIȚIA XII 10
IV. INTRODUCERE 13
ARTICOLE GENERALE DE FARMACOPIE
1. Reguli de utilizare a monografiilor farmacopee (OFS 42-0031-07) 17
2. Unități ale sistemului internațional (SI) utilizate în farmacopee și corespondența lor cu alte unități (OFS 42-0032-07) 22
METODE DE ANALIZĂ 26
3. Echipamente (OFS42-0033-07) 26
METODE FIZICE ȘI FIZICOCHIMICE DE ANALIZĂ 29
4. Punct de topire (OFS 42-0034-07) 29
5. Temperatura de solidificare (OFS 42-0035-07) 34
6. Limitele de temperatură ale distilării și ale punctului de fierbere (OFS 42-0036-07) 36
7. Densitate (OFS 42-0037-07) 38
8. Vâscozitatea (OFS 42-0038-07) 41
9. Determinarea alcoolului etilic în preparatele farmaceutice lichide (OFS 42-0039-07) 49
10. Refractometrie (OFS 42-0040-07) 52
11. Polarimetrie (OFS 42-0041 -07) 54
12. Metode spectroscopice 56
12.1. Spectrofotometrie în regiunile ultraviolete și vizibile (OFS 42-0042-07) 56
12.2. Spectrometrie în infraroșu (OFS 42-0043-07) 62
12.3. Spectrometrie de emisie atomică și absorbție atomică (OFS 42-0044-07) 66
12.4. Fluorimetrie (OFS 42-0045-07) 70
12.5. Spectroscopie prin rezonanță magnetică nucleară (OFS42-0046-07) 73
13. Osmolaritatea (OFS 42-0047-07) 78
14. Ioiom & trt (OFS 42-0048-07) 85
15. Solubilitate (OFS 42-0049-07) 92
16. Gradul de culoare al lichidelor (OFS 42-0050-07) 93
17. Transparența și turbiditatea lichidelor (OFS 42-0051-07) 98
ANALIZA CHIMICĂ 101
18. Determinarea azotului în compuși organici prin metoda Kjeldahl (OFS 42-0052-0 7) 101
19. Determinarea proteinelor (OFS 42-0053-07) 105
20. Nitritometrie SOFS 42-0054-0 7) 114
TEST PENTRU LIMITE DE IMPURITĂȚI 115
21. Cenușă totală (OFS 42-0055-07) 115
22. Cenușă sulfatată (OFS 42-0056-07) 115
23. Solvenți organici reziduali (OFS 42-0057-07) 115
24. Test pentru puritate și limite ale impurităților 118
24.1. Fier (OFS 42-0058-07) 119
24.2. Metale grele (OFS 42-0059-07) 121
METODE DE CONTROL BIOLOGIC 124
25. Toxicitate anormală (OFS 42-0060-07) 124
26. Pirogenitate (OFS 42-0061-07) 125
27. Endotoxine bacteriene (OFS 42-0062-07) 128
28. Test pentru histamină ("OFS 42-0063-07) 136
29. Test pentru depresive (OFS 42-0064-07) 140
30. Metode biologice de evaluare a activității plantelor medicinale și a produselor medicamentoase care conțin glicozide cardiace (OFS 42-0065-07) 141
31. Sterilitate (OFS 42-0066-0 7) 150
32. Puritate microbiologică (OFS 42-0067-07) 160
33. Determinarea activității antimicrobiene a antibioticelor prin difuzie în agar (OFS 42-0068-0 7) 194
34. Determinarea eficacității conservanților antimicrobieni ai medicamentelor (OFS 42-0069-07) 216
REACTIVI 220
35. Reactivi. Indicatori (OFS 42-0070-07) 220
36. Soluții titrate (OFS 42-0071-07) 425
37. Soluții tampon (OFS 42-0072-07) 443
38. Radiofarmaceutice (OFS 42-0073-07) 456
39. Substanțe farmaceutice (OFS 42-0074-07) 484
40. Perioada de valabilitate a medicamentelor (OFS 42-0075-07) 488
Articole de farmacopee 493
Descărcați gratuit o carte electronică într-un format convenabil, urmăriți și citiți:
Descărcați cartea Farmacopeea de stat a Federației Ruse, ediția a XII-a, Partea 1, 2007 - fileskachat.com, descărcare rapidă și gratuită.
Descărcați fișierul nr. 1 - doc
Descărcați fișierul numărul 2 - djvu
Mai jos puteți cumpăra această carte la cel mai bun preț redus, cu livrare în toată Rusia.
MINISTERUL SĂNĂTĂȚII FEDERAȚIEI RUSII
ARTICOLUL FARMACOPEAN
GinsengprezentulrădăciniFS.2.5.0013.15
Panacis ginseng radices În loc de GFXI, Nu. 2, art. 66
Colectate la sfârșitul lunii august - începutul lunii septembrie și rădăcini uscate ale unei plante perene sălbatice și cultivate, ginseng prezent - Panax ginseng C. A. Mey, acest. aralievs - Araliaceae.
AUTENTICITATE
Semne externe. Materii prime întregi. Rădăcini de până la 25 cm lungime, 0,7 - 2,5 cm grosime, cu 2 - 5 ramuri mari, mai rar fără ele. Rădăcinile de bază, longitudinal, mai rar spiralate, încrețite, fragile, chiar fracturate. „Corpul” rădăcinii este îngroșat, aproape cilindric, de sus cu îngroșări inelare pronunțate. În partea superioară a rădăcinii există un rizom ridat transversal îngust - „gât”. Rizomul este scurt, cu mai multe cicatrici din tulpini căzute, în partea de sus formează un „cap”, care este un rest extins al tulpinii și un mugur apical (uneori 2-3). Una sau mai multe rădăcini accidentale se extind uneori de la „gât”. Este posibil să lipsească „gâtul” și „capul”. Culoarea rădăcinilor de la suprafață și de pe tăietură este alb-gălbuie, pe o fractură proaspătă este albă. Mirosul este specific. Gustul extractului apos este dulce, înțepător, apoi picant-amar.
Materii prime mărunțite. La examinarea materiei prime zdrobite sub o lupă (10 ×) sau un stereomicroscop (16 ×), bucăți de rădăcini de diferite forme sunt vizibile, trecând printr-o sită cu deschideri de 7 mm. Culoarea de la suprafață și la fractură este alb-gălbuie. Mirosul este specific. Gustul extractului apos este dulce, înțepător, apoi picant-amar.
Pudra... Atunci când se examinează pulberea sub o lupă (10 ×) sau un stereomicroscop (16 ×), se vede un amestec de particule zdrobite de diferite forme de culoare alb-gălbuie trecând printr-o sită cu găuri de 2 mm. Mirosul este specific. Gustul extractului apos este dulce, înțepător, apoi picant-amar.
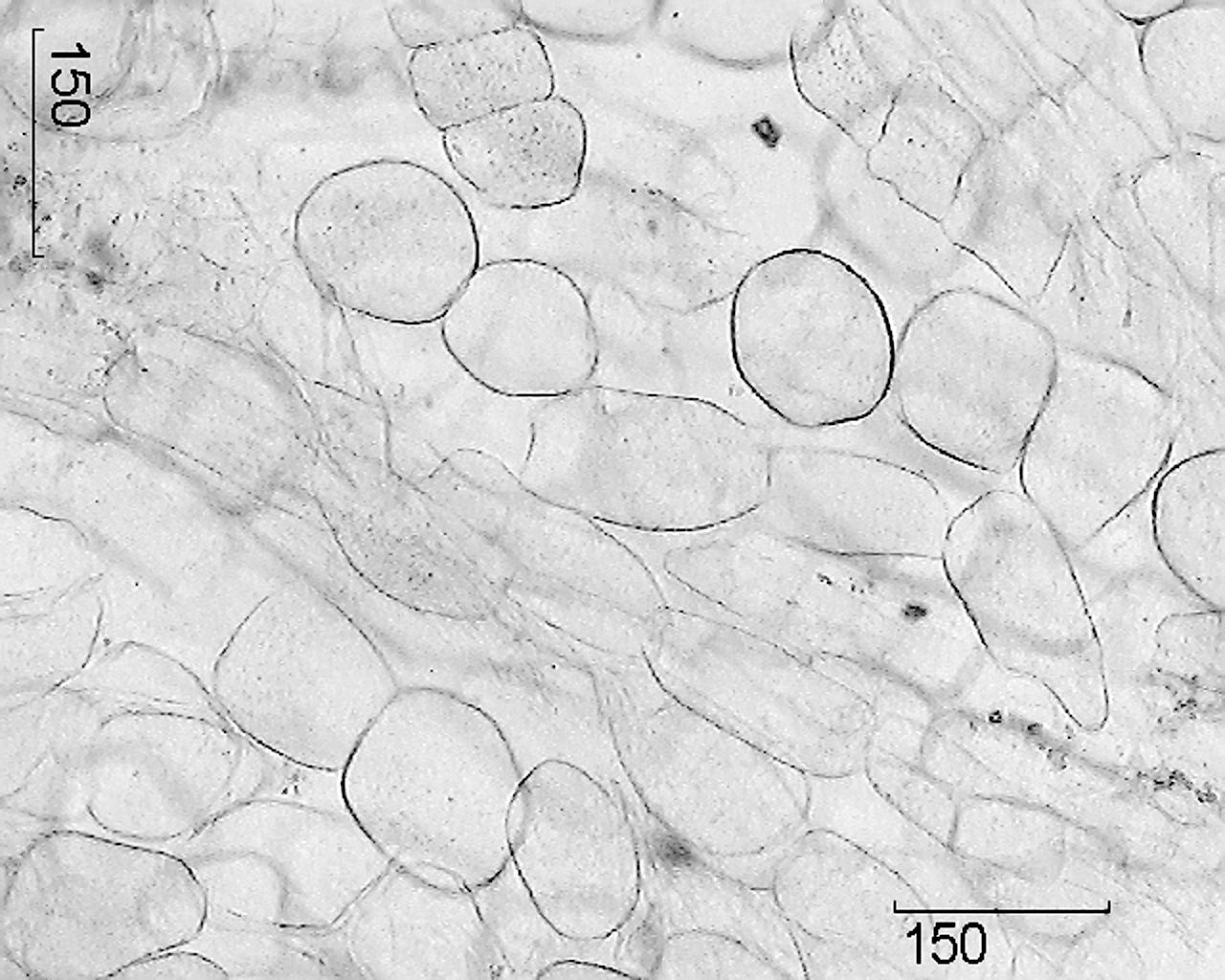
Semne microscopice. Materii prime întregi. Secțiunea transversală a rădăcinii principale prezintă un strat îngust de plută maro deschis, o scoarță largă, o linie de cambium limpede și lemn.
Rădăcina principală este acoperită cu periderm, ale cărui celule sunt cu pereți subțiri și lignificate, nu dopate. Floema și xilema sunt separate de o zonă cambială, care trece aproximativ prin mijlocul razei rădăcinii și
uneori nu este vizibil. La periferia xilemului primar, pleacă raze radiale primare cu celule mari ale țesutului parenchimatic, între care există un xilem secundar, traversat de numeroase raze radiale secundare ale parenchimului principal. Xilemul este format din celule parenchimatoase cu pereți subțiri care conțin boabe de amidon. Vasele razelor medulare au pereți lignificați îngroșați și sunt localizați singuri sau colectați în grupuri de 3-6. În parenchimul lemnului, rareori se găsesc celule care conțin pigmenți galbeni. În centrul rădăcinii există rămășițe diagnosticate în mod indistinct ale xilemului primar sub formă de 2 raze. Floemul constă în principal din elemente cu celule mici; conține recipiente schizogene bine vizibile care conțin picături de secreție de la galben deschis la roșu-maroniu. Boabele de amidon sunt mici, rotunde, simple. Drusurile de oxalat de calciu sunt conținute în celulele individuale ale parenchimului. Partea exterioară a cortexului secundar este mărginită de o zonă de câteva (4 - 6) rânduri de celule mari parenchimale tangente-alungite de feloderm, rotunde sau ovale, cu o membrană ușor îngroșată.
|
|
||
|
|
|
|
|
|
|
|
Desen - Ginseng adevărate rădăcini.
1 - un fragment dintr-o secțiune transversală a rădăcinii principale (100 ×); 2 - un fragment de dop (400 ×); 3 - un fragment dintr-o secțiune transversală a rădăcinii accidentale: a - vase de xilem, b - boabe de amidon (400 ×); 4 - un fragment al secțiunii transversale a rădăcinii principale cu un canal secretor: a - celule de căptușeală ale canalului, b - cavitatea canalului (400 ×); 5 - un fragment din parenchimul razelor medulare: a - druze de oxalat de calciu, b - boabe de amidon (400 ×); 6 - celule ale parenchimului razei medulare (100 ×).
Pe secțiunea transversală a rădăcinii accidentale din centru, raza vaselor xilemului primar este restul fasciculului conductiv diarhic din structura primară. Cele două sectoare ale xilemului secundar sunt separate de razele radiale ale parenchimului primar. Celulele parenchimului sunt rotunde sau ovale, parțial sau complet umplute cu boabe de amidon. Pluta este formată din 5 - 7 straturi de celule dreptunghiulare, cu pereți subțiri, slab lignificate.
Materii prime mărunțite... La examinarea preparatului zdrobit, fragmente de secțiuni transversale și longitudinale ale rădăcinilor principale și accidentale ar trebui să fie vizibile.
Fragmente din rădăcina principală sunt reprezentate de raze și vase ale xilemului, umplând celulele parenchimului razelor medulare cu boabe de amidon, cavități de canal și celule de căptușeală, celule parenchimatoase cu pigmenți și celule cambium.
Fragmente de rădăcină adventivă sunt reprezentate de celule de plută, parenchim cu boabe de amidon, recipiente, cortex primar și secundar, vase, raze medulare.
Pudra. La examinarea micropreparării, sunt vizibile fragmente de epidermă, plută, lemn, parenchim, precum și druse de oxalat de calciu.
Determinarea principalelor grupe de substanțe biologic active
Cromatografia în strat subțire
Pe linia de pornire a unei plăci cromatografice analitice cu un strat de silicagel cu un indicator fluorescent care măsoară 10 × 15 cm pe un substrat de aluminiu, aplicați 20 μl din soluția testată (a se vedea secțiunea "Determinarea cantitativă" prepararea soluției A din soluție de test) și 50 μl dintr-o probă standard (SS) soluție de panaxozid Rg 1 (a se vedea secțiunea "Determinarea cantitativă" prepararea soluției A CO panaxozid Rg 1). Placa cu probele aplicate este uscată în aer, plasată într-o cameră, pre-saturată timp de cel puțin 2 ore cu un amestec de solvenți cloroform - metanol - apă (26: 14: 3) și cromatografiată în mod ascendent. Când partea din față a solvenților trece aproximativ 80 - 90% din lungimea plăcii de la linia de pornire, aceasta este îndepărtată din cameră, uscată până când urmele de solvenți sunt îndepărtate, tratate cu acid fosfotungstic cu o soluție de alcool de 20% și încălzite într-un cuptor la 100 - 105 ° C timp de 3 minute, după care este vizionat în lumina zilei.
Cromatograma soluției de testare trebuie să prezinte cel puțin 6 zone de adsorbție de la roz deschis la roz închis; zona dominantă este la nivelul zonei de pe cromatograma soluției de CO de panaxozid Rg 1; este permisă detectarea altor zone de adsorbție.
Când se aplică o picătură de acid sulfuric concentrat pe pulberea rădăcinilor de ginseng, apare o culoare roșu-cărămidă după 1-2 minute, transformându-se în roșu-violet și apoi în violet (panaxozide).
Testarea
Umiditate. Materii prime întregi, materii prime mărunțite, pulbere - nu mai mult de 13%.
Cenușa este obișnuită. Materii prime întregi, materii prime mărunțite, pulbere - nu mai mult de 5%.
Cenușă insolubilă în acid clorhidric. Materii prime întregi, materii prime mărunțite, pulbere - nu mai mult de 2%.
Măcinarea materiilor prime.Materii prime întregi: particule care trec printr-o sită cu deschideri de 3 mm, nu mai mult de 5%. Materii prime mărunțite: particule care nu trec printr-o sită cu deschideri de 7 mm, nu mai mult de 5%; particule care trec printr-o sită cu deschideri de 0,5 mm, nu mai mult de 5%. Pudra: particule care nu trec printr-o sită cu găuri de 2 mm, nu mai mult de 5%; particule care trec printr-o sită cu găuri de 0,18 mm, nu mai mult de 5%.
Impurităţi
Rădăcinile s-au întunecat de la suprafață . Materii prime întregi, materii prime mărunțite - nu mai mult de 3%.
Impuritate organică. Materii prime întregi, materii prime mărunțite - nu mai mult de 0,5%.
Amestec mineral . Materii prime întregi, materii prime mărunțite, pulbere - nu mai mult de 1%.
Metale grele. În conformitate cu cerințele monografiei generale a farmacopeei „Determinarea conținutului de metale grele și arsenic în materiile prime ale plantelor medicinale și preparatele pe bază de plante medicinale”.
Radionuclizii.În conformitate cu cerințele monografiei generale a farmacopeei „Determinarea conținutului de radionuclizi din materiile prime pentru plante medicinale și preparatele pe bază de plante medicinale”.
Cantități reziduale de pesticide... În conformitate cu cerințele monografiei generale a farmacopeei „Determinarea conținutului de pesticide reziduale în materii prime pentru plante medicinale și preparate medicinale pe bază de plante”.
Puritate microbiologică.În conformitate cu cerințele monografiei generale de farmacopee „Puritate microbiologică”.
cuantificare. Materii prime întregi, materii prime mărunțite, pudra: cantitatea de panaxozide în termeni de panaxozid Rg 1 nu mai puțin de 2%; extractivi extractibili cu 70% alcool, nu mai puțin de 20%.
("Farmacopeea de stat a Federației Ruse. Ediția a XIII-a. Volumul I")
Această monografie generală farmacopeică stabilește cerințe generale pentru depozitarea substanțelor farmaceutice, a excipienților și a produselor medicamentoase și se aplică tuturor organizațiilor în care sunt depozitate medicamentele, luând în considerare tipul de activitate al organizației.
Depozitarea plantelor medicinale și a produselor medicinale pe bază de plante se efectuează în conformitate cu monografia generală a farmacopeei „Depozitarea plantelor medicinale și a produselor medicinale pe bază de plante”.
Depozitare- procesul de depozitare a medicamentelor până la momentul utilizării acestora în termenul de valabilitate stabilit, care face parte integrantă din circulația medicamentelor.
Cerințe generale pentru încăperi de depozitare
medicamente și organizarea depozitării acestora
Depozitarea medicamentelor trebuie efectuată în spații destinate acestor scopuri. Proiectarea, compoziția, dimensiunile zonelor de depozitare, funcționarea și echipamentul acestora trebuie să asigure condiții adecvate de depozitare pentru diferite grupuri de medicamente.
Complexul de facilități de depozitare ar trebui să includă:
- o cameră (zonă) de recepție destinată despachetării și primirii pachetelor cu medicamente și examinarea preliminară a acestora;
- cameră (zonă) pentru prelevarea de probe de medicamente în conformitate cu cerințele monografiei generale a farmacopeei „Prelevare”;
- spații (zone) pentru depozitarea în carantină a medicamentelor;
- incinte pentru medicamente care necesită condiții speciale de depozitare;
- o cameră (zonă) pentru depozitarea medicamentelor respinse, returnate, retrase și / sau expirate. Aceste medicamente și locațiile lor de depozitare trebuie să fie clar marcate.
O zonă de depozitare este alocată într-o cameră de depozitare comună, fără o cameră separată izolată.
Decorarea spațiilor pentru depozitarea medicamentelor trebuie să îndeplinească cerințele sanitare și igienice actuale, suprafețele interioare ale pereților și tavanelor trebuie să fie netede, permițând curățarea umedă.
În fiecare cameră de depozitare, este necesar să se mențină un regim climatic, respectând temperatura și umiditatea aerului stabilite prin monografia farmacopeică sau documentația de reglementare pentru medicamente.
Schimbul de aer necesar în încăperile de depozitare este creat cu ajutorul aparatelor de aer condiționat, al ventilației de alimentare și evacuare sau al altor echipamente. Iluminarea naturală și artificială din încăperile de depozitare trebuie să asigure funcționarea corectă și sigură a tuturor operațiunilor în interior. Dacă este necesar, trebuie asigurată protecția medicamentelor împotriva radiațiilor solare.
Spațiile pentru depozitarea medicamentelor trebuie să fie dotate cu numărul necesar de instrumente de măsurare (termometre, higrometre, psihrometre etc.) verificate în conformitate cu procedura stabilită pentru monitorizarea și înregistrarea temperaturii și umidității, efectuată cel puțin o dată pe zi.
Instrumentele de măsurare sunt plasate la o distanță de cel puțin 3 metri de uși, ferestre și dispozitive de încălzire într-un loc accesibil pentru citirea citirilor, la o înălțime de 1,5-1,7 metri de podea. În același timp, se recomandă amplasarea lor în locuri în care există cea mai mare probabilitate de fluctuații ale temperaturii și umidității sau se observă cel mai adesea abateri de la parametrii solicitați.
Înregistrările trebuie să demonstreze condițiile de temperatură și umiditate stabilite pentru incinte și, dacă nu corespund, acțiuni corective.
Spațiile de depozitare trebuie să fie echipate cu un număr suficient de dulapuri, seifuri, rafturi, podkazhny, paleți. Echipamentul trebuie să fie în stare bună și curat.
Rafturile, dulapurile și alte echipamente trebuie instalate astfel încât să ofere acces la medicamente, trecerea liberă a personalului și, dacă este necesar, accesibilitatea operațiunilor de încărcare și descărcare, precum și accesibilitatea echipamentelor, pereților, podelei camerei pentru curatenie.
În spațiile de depozitare a medicamentelor trebuie menținut un regim sanitar adecvat. Frecvența și metodele de curățare a spațiilor trebuie să respecte cerințele documentelor de reglementare. Dezinfectanții sanitari folosiți trebuie să fie siguri, trebuie exclus riscul de contaminare a medicamentelor depozitate prin aceste mijloace.
Ar trebui elaborate instrucțiuni speciale de curățare pentru medicamentele vărsate sau vărsate pentru a elimina complet și a preveni contaminarea altor medicamente.
Atunci când efectuează lucrări în spațiile de depozitare a medicamentelor, angajații trebuie să poarte îmbrăcăminte și încălțăminte speciale și să respecte regulile de igienă personală.
Medicamentele sunt plasate în încăperi de depozitare în conformitate cu condițiile de depozitare specificate în monografia farmacopeică sau în documentele de reglementare pentru medicamente, luând în considerare proprietățile lor fizico-chimice și periculoase, efectele farmacologice și toxicologice, tipul de formă de dozare a medicamentului și metoda a utilizării sale, agregează starea medicamentului. Atunci când se utilizează tehnologii informatice, este permisă plasarea medicamentelor conform principiului alfabetic, conform codurilor.
Trebuie identificate rafturile, dulapurile, rafturile pentru depozitarea medicamentelor. De asemenea, este necesar să identificați medicamentele stocate utilizând un card de tip rack, atunci când utilizați tehnologia computerului - folosind coduri și dispozitive electronice.
Cu metoda manuală de descărcare și operațiuni de încărcare, înălțimea stivuirii medicamentelor nu trebuie să depășească 1,5 metri. Atunci când se utilizează dispozitive mecanizate în timpul operațiunilor de descărcare și încărcare, medicamentele trebuie depozitate în mai multe niveluri. În același timp, înălțimea totală a plasării medicamentelor pe rafturi nu trebuie să depășească capacitățile mecanismelor de încărcare și descărcare.
Medicamentele din camerele de depozitare trebuie plasate în dulapuri, pe rafturi, păstăi, paleți etc. Nu este permisă plasarea medicamentelor pe podea fără palet.
Paletele pot fi așezate pe podea într-un rând sau pe rafturi în mai multe niveluri, în funcție de înălțimea raftului. Nu este permisă plasarea paleților cu medicamente pe mai multe rânduri în înălțime fără a utiliza rafturi.
Atunci când creați condiții de depozitare pentru un singur medicament, este necesar să respectați cerințele specificate în monografia sau documentația de reglementare pentru acest medicament, stabilite de producătorul (dezvoltatorul) medicamentului pe baza rezultatelor studiului de stabilitate în conformitate cu cu monografia generală a farmacopeei „Perioada de valabilitate a medicamentelor”.
Depozitarea medicamentelor se efectuează în ambalaje (consumator, grup) care îndeplinesc cerințele documentelor de reglementare pentru acest medicament.
Depozitarea medicamentelor se efectuează la o umiditate relativă de cel mult 60% +/- 5%, în funcție de zona climatică respectivă (I, II, III, IVA, IVB), dacă condițiile speciale de depozitare nu sunt specificate în regulament documentație.
Medicamentele trebuie păstrate pentru a preveni contaminarea, amestecarea și contaminarea încrucișată. Ar trebui evitate mirosurile străine din camerele de depozitare.
Ar trebui implementat un sistem de înregistrare a medicamentelor cu termen de valabilitate limitat, stabilit în organizație. Dacă mai multe loturi cu același nume de medicament sunt depozitate, atunci medicamentul trebuie luat în primul rând pentru utilizare, a cărui dată de expirare expiră mai devreme decât cea a altora.
Medicamentele respinse trebuie identificate și depozitate într-o cameră (zonă) adecvată în condiții care împiedică utilizarea lor neautorizată.
Caracteristici ale depozitării anumitor grupuri de medicamente
Medicamentele cu proprietăți periculoase (inflamabile, explozive, radiofarmaceutice, caustice, corozive, gaze comprimate și lichefiate etc.) trebuie depozitate în încăperi special amenajate, echipate cu echipamente suplimentare de siguranță și securitate.
În timpul depozitării, este necesar să se asigure siguranța și calitatea declarată a medicamentelor, să se prevină posibilitatea ca medicamentele să își manifeste proprietățile periculoase și să se creeze condiții de lucru sigure pentru angajații care lucrează cu astfel de medicamente.
Atunci când se organizează spații și se organizează depozitarea medicamentelor periculoase, este necesar să se ghideze după cerințele legilor federale și ale actelor juridice de reglementare ale Federației Ruse.
Depozitarea medicamentelor narcotice și psihotrope trebuie efectuată în conformitate cu legile și reglementările federale ale Federației Ruse.
La depozitarea medicamentelor care necesită protecție împotriva influenței factorilor de mediu (lumină, temperatură, compoziția atmosferică a aerului etc.), este necesar să se asigure modul de stocare specificat în monografie sau în documentația de reglementare. Abaterile de la condițiile reglementate sunt permise o singură dată pentru o perioadă scurtă de timp (nu mai mult de 24 de ore), cu excepția cazului în care condițiile speciale, de exemplu, depozitarea permanentă într-un loc rece, sunt specificate separat.
Medicamentele care, sub influența energiei luminoase, își pot schimba proprietățile (se oxidează, refac, descompun, își pot schimba culoarea etc.), sunt foto- sau fotosensibile; medicamentele rezistente la lumină sunt fotostabile. Influența energiei luminoase se poate manifesta prin expunerea la lumina directă a soarelui, lumina împrăștiată în regiunea vizibilă a spectrului luminos și radiația din regiunea ultravioletă.
Etichetarea medicamentelor fotosensibile, de regulă, conține instrucțiunea: „A se păstra într-un loc întunecat”. Medicamentele care necesită protecție împotriva luminii trebuie depozitate în camere sau în zone special echipate, care asigură protecție împotriva luminii naturale și artificiale.
Substanțele farmaceutice care necesită protecție împotriva luminii trebuie depozitate fie în ambalaje realizate din materiale de protecție împotriva luminii, fie într-o cameră întunecată sau dulapuri. Dacă recipientele din sticlă pentru produse farmaceutice sunt utilizate ca ambalaje pentru substanțele farmaceutice care sunt deosebit de sensibile la lumină, este necesar să acoperiți recipientul cu hârtie neagră opacă.
Produsele medicamentoase fotosensibile trebuie ambalate în ambalaje secundare (de consum) de protecție împotriva luminii și / sau trebuie depozitate într-un loc ferit de lumină.
Medicamentele care, în contact cu apa, umezeala, pot emite gaze etc., sunt sensibile la umiditate. Etichetarea medicamentelor sensibile la umiditate, de regulă, conține instrucțiunea: „A se păstra într-un loc uscat”.
Când depozitați astfel de medicamente, este necesar să creați condiții astfel încât umiditatea relativă a aerului să nu depășească 50% la temperatura camerei (în condiții normale de depozitare) sau presiunea de vapori echivalentă la o temperatură diferită. Îndeplinirea cerinței prevede, de asemenea, stocarea unui medicament sensibil la umiditate într-un pachet etanș (rezistent la umiditate) pentru consumatori, care asigură protecția specificată și respectarea condițiilor de depozitare în timpul circulației medicamentului.
Pentru a menține un conținut scăzut de umiditate în timpul depozitării medicamentelor, în cazuri stabilite, se utilizează agenți de uscare, cu condiția să fie exclus contactul lor direct cu medicamentul.
Medicamentele cu proprietăți higroscopice trebuie păstrate la o umiditate relativă de cel mult 50% într-un pachet care este un recipient de sticlă pentru medicamente, închis ermetic sau într-un pachet cu protecție suplimentară, de exemplu, într-o pungă de film din plastic, în conformitate cu cu cerințele Monografiei Farmacopeei sau a documentației de reglementare.
Unele grupuri de medicamente își schimbă proprietățile sub influența gazelor atmosferice, cum ar fi oxigenul sau dioxidul de carbon. Pentru a asigura protecția medicamentelor împotriva efectelor gazelor, se recomandă depozitarea medicamentelor într-un pachet sigilat din materiale impermeabile la gaze. Ambalajul, dacă este posibil, trebuie umplut până la vârf și sigilat etanș.
Medicamente care sunt de fapt medicamente volatile sau medicamente care conțin un solvent volatil; soluții și amestecuri de substanțe volatile; Medicamentele care se descompun odată cu formarea produselor volatile necesită crearea unor condiții de depozitare care să le protejeze de volatilizare și uscare. Se recomandă depozitarea medicamentelor într-un loc răcoros, într-un ambalaj închis ermetic din materiale impermeabile substanțelor volatile sau în ambalaje primare și secundare (de consum) în conformitate cu cerințele specificate în monografia farmacopei sau în documentele de reglementare.
Medicamentele, care sunt substanțe farmaceutice care conțin apă de cristalizare (hidrați cristalini), prezintă proprietățile substanțelor higroscopice. Se recomandă depozitarea hidraților cristalini într-un ambalaj închis ermetic, în conformitate cu cerințele specificate în monografia farmacopei sau în documentația de reglementare. De regulă, hidrații cristalini sunt depozitați la o temperatură de 8 până la 15 ° C și o umiditate relativă de cel mult 60%.
Medicamentele care își schimbă proprietățile sub influența temperaturii ambiante sunt sensibile la căldură. Medicamentele își pot schimba proprietățile sub influența temperaturilor camerei și a temperaturilor mai ridicate (medicamente termolabile) sau sub influența temperaturilor scăzute, inclusiv a înghețului.
La depozitarea medicamentelor termosensibile, este necesar să se asigure regimul de temperatură, reglementat de cerințele monografiei farmacopeice sau a documentației de reglementare, indicate pe ambalajul primar și / sau pe ambalajul secundar (de consum) al medicamentului.
Medicamentele termolabile trebuie depozitate în camere special echipate (camere frigorifice) sau în camere de depozitare dotate cu un număr suficient de dulapuri frigorifice și frigidere. Pentru depozitarea medicamentelor termolabile, trebuie folosite frigidere farmaceutice sau frigidere pentru sânge și produse din sânge.
Calitatea adecvată a medicamentelor imunobiologice, siguranța și eficacitatea utilizării lor sunt asigurate de sistemul „lanțului rece”, care trebuie efectuat la toate cele patru niveluri ale acestuia.
Rezoluția medicului șef sanitar de stat al Federației Ruse nr. 15 din 04/10/2002 „Cu privire la introducerea normelor sanitare și epidemiologice SP 3.3.2.1120-02”
Frigiderele (camere, dulapuri) trebuie setate la o temperatură corespunzătoare regimului de temperatură pentru depozitarea medicamentelor conținute în ele. Depozitarea medicamentelor imunobiologice trebuie efectuată la o temperatură care nu depășește 8 ° C. Fiecare pachet de medicament imunobiologic din frigider trebuie să aibă acces la aerul răcit. Nu este permisă depozitarea în comun a medicamentelor imunobiologice cu alte medicamente în frigider.
Pentru a monitoriza regimul de temperatură al depozitării medicamentelor termolabile, toate frigiderele (camere, dulapuri) trebuie prevăzute cu termometre. Monitorizarea continuă a regimului de temperatură se efectuează folosind termografe și înregistratoare de temperatură, ale căror citiri sunt înregistrate cel puțin de două ori pe zi.
Regimul de temperatură pe rafturile frigiderului este diferit: temperatura este mai scăzută în apropierea congelatorului, mai mare - lângă panoul ușii deschise.
Furnizarea unui loc rece înseamnă depozitarea medicamentelor într-un frigider la o temperatură de 2 până la 8 ° C, evitând înghețarea. Depozitarea într-un loc răcoros înseamnă depozitarea medicamentelor la o temperatură de 8-15 ° C. În acest caz, este permisă depozitarea medicamentelor în frigider, cu excepția medicamentelor care, atunci când sunt depozitate la o temperatură a frigiderului sub 8 ° C, își pot modifica caracteristicile fizico-chimice, de exemplu, tincturi, extracte lichide etc.
Depozitarea la temperatura camerei implică un regim de temperatură de la 15 la 25 ° C sau, în funcție de condițiile climatice, până la 30 ° C. Depozitarea la congelator asigură un regim de temperatură a medicamentelor de la -5 la -18 ° C. Depozitarea în condiții de îngheț profund asigură un regim de temperatură sub -18 ° C.
Este recomandabil să plasați medicamente în zone și pe rafturile frigiderului corespunzătoare temperaturii lor de depozitare. Depozitarea medicamentelor imunobiologice pe panoul ușii frigiderului nu este permisă.
În încăperile de depozitare, este necesar să se asigure condiții de depozitare pentru medicamentele care necesită protecție împotriva expunerii la temperaturi scăzute, pentru care limita inferioară a temperaturii de depozitare este stabilită în monografie sau în documentația de reglementare.
Nu este permisă congelarea medicamentelor care au cerințele relevante în monografie sau în documentele de reglementare și sunt indicate pe ambalajul primar sau secundar, inclusiv preparatele de insulină, preparatele imunobiologice adsorbite etc.
Nu este permisă înghețarea medicamentelor plasate în ambalaje care pot fi distruse prin congelare, de exemplu, medicamente în fiole, flacoane de sticlă etc.
Definițiile utilizate în farmacopeea care caracterizează regimurile de temperatură ale stocării medicamentelor sunt date în tabel.
Este necesar să se asigure respectarea condițiilor de depozitare a medicamentelor și să se păstreze integritatea acestora în timpul transportului.
Pentru medicamentele care sunt deosebit de sensibile la schimbările de temperatură (vaccinuri, seruri și alte medicamente imunobiologice, insulinice etc.), în timpul transportului, trebuie respectat regimul de temperatură reglementat de monografia farmacopeică sau de documentele de reglementare.
Definiții care caracterizează regimurile de stocare a medicamentelor
Monografii generale și monografii ale Farmacopeei de Stat din Federația Rusă
Ediția a XIII-a
V.A. Merkulov, E.I. Sakanyan, T.B. Shemeryankina, O.A. Mochikina, N. D. Bunyatyan
Instituția bugetară federală de stat „Centrul științific pentru expertiza produselor medicamentoase” din Ministerul Sănătății al Federației Ruse, 127051, Moscova, Rusia
Rezumat: Farmacopeea de stat a Federației Ruse este o colecție de monografii și monografii generale de farmacopee și poate fi retipărită cel puțin o dată la 5 ani. Următoarea ediție a Farmacopeei de Stat a Federației Ruse, planificată pentru publicare în 2015, va include atât monografii generale, cât și monografii farmacopeice, care au fost dezvoltate pentru prima dată în practica analizei farmacologice interne și, în unele cazuri, la nivel mondial, precum și articole care sunt versiuni actualizate și revizuite.monografii generale și monografii. Introducerea monografiilor și monografiilor farmacopee generale ale acestei ediții a Farmacopeei de Stat din Federația Rusă va crește semnificativ nivelul analizei farmacopeei interne și va asigura conformitatea acesteia cu cerințele standardelor mondiale.
Cuvinte cheie: farmacopeea de stat; monografie generală farmacopeică; monografie farmacopeică; calitatea medicamentelor; analiza farmacopeului.
Descriere bibliografică: Merkulov VA, Sakanyan EI, Shemeryankina TB, Mochikina OA, Bunyatyan ND. Monografii generale și monografii ale Farmacopeei de Stat din Federația Rusă, ediția a XIII-a. Vedomosti al Centrului științific pentru expertiza medicamentelor 2015; (2): 54-58.
MONOGRAFII GENERALE ȘI MONOGRAFII FARMACOPOEIALE A FARMACOPOIEI DE STAT A Federației RuSSIAN, ediția a III-a v.A. Merkulov, E.I. Sakanyan, T.B. Shemeryankina, O.A. Mochikina, N.D. Bunyatyan
Instituția bugetară federală de stat „Centrul științific pentru evaluarea expertă a medicamentelor” din Ministerul Sănătății al Federației Ruse, 127051, Moscova, Rusia
Rezumat: Farmacopeea de stat a Federației Ruse este o colecție de monografii generale și monografii farmacopeice. Ar trebui să fie reeditat cel puțin o dată la 5 ani. Următoarea ediție programată a Farmacopeei de Stat a Federației Ruse este planificată pentru publicare în 2015. Aceasta va include atât elaborate pentru prima dată în monografii naționale și, în unele cazuri, analize farmacopeice globale și monografii generale și farmacopee, cât și monografii generale și farmacopee revizuite actualizate. Implementarea monografiilor generale și farmacopee ale ediției menționate a Farmacopeei de Stat din Federația Rusă va crește semnificativ nivelul analizei naționale farmacopeice și va asigura conformitatea acesteia cu standardele internaționale.
Cuvinte cheie: Farmacopeea de stat; monografie generală; monografie farmacopeică; calitatea medicamentelor; analiza farmacopeului.
Descriere bibliografică: Merkulov VA, Sakanyan EI, Shemeryankina TB, Mochikina OA, Bunyatyan ND. Monografii generale și monografii farmacopee ale farmacopeei de stat din Federația Rusă, ediția a XIII-a. Centrul științific pentru evaluarea de către experți a medicamentelor Buletin 2015; (2): 54-58.
Scopul principal urmărit de Farmacopeea de Stat a Federației Ruse (GF RF) este standardizarea calității medicamentelor aflate în circulație pe piața farmaceutică internă.
În prezent, pe teritoriul Federației Ruse există o ediție GF X (1968), o ediție GF XI (partea 1 - 1987, partea 2 - 1989), precum și o ediție GF XII (partea 1 - 2007). Datele de lansare indicate pentru aceste ediții ale GF indică faptul că acestea nu îndeplinesc cerințele actualei legi federale din 12 aprilie 2010 „Cu privire la circulația medicamentelor” nr. 61-FZ pentru momentul reeditării Farmacopeei de Stat .
În ciuda acestui fapt, monografiile generale (OFS) și monografiile (FS) incluse în edițiile Farmacopeei de Stat X-X11 nu au fost anulate. Unele dintre ele au nevoie de revizuire, unele dintre articole și-au pierdut deja relevanța din cauza lipsei de cerere. Acestea includ OFS precum "Metoda biologică pentru determinarea activității soluției 0,1% de clorhidrat de epinefrină", "Testul biologic
novarsenol și miarsenol "," Determinarea gradului de alb al medicamentelor sub formă de pulbere "și altele. De asemenea, este necesară eliminarea FS pentru medicamentele retrase din circulație. În plus, produsele farmaceutice aprobate în perioada dintre eliberarea farmacopeilor, conform cărora întreprinderile individuale produc medicamente și monitorizează calitatea acestora, trebuie revizuite, deoarece metodele de analiză farmacopeică sunt în mod constant îmbunătățite.
În prezent, 229 OFS și 179 FS au fost pregătite pentru a fi incluse în următoarea ediție a XIII-a a Fondului de Stat al Federației Ruse. Ele pot fi împărțite în secțiuni corespunzătoare.
Secțiunea „Monografii generale farmacopeice” conține: articole despre metode generale, preparate farmaceutice generale privind metodele de analiză, reactivi, forme de dozare și metode de analiză a acestora; materii prime pentru plante medicinale și metode de evaluare a calității acesteia; grupuri de medicamente imunobiologice și metode de analiză a acestora; medicamente din sânge și plasmă sanguină la oameni și animale și metode de analiză utilizate pentru evaluarea calității acestora; medicamente radiofarmaceutice.
Monografiile farmacopeului sunt prezentate în secțiunile „Substanțe farmaceutice” și „Preparate medicinale”. Secțiunea „Substanțe farmaceutice” este reprezentată de monografii farmacopeice pentru substanțe farmaceutice de origine sintetică sau minerală, utilizate ca substanțe active și / sau auxiliare. În plus, monografiile farmacopee privind materiile prime ale plantelor medicinale utilizate în producția farmaceutică, inclusiv produsele medicinale pe bază de plante, sunt prezentate sub forma unei subsecțiuni separate. Secțiunea „Medicamente” constă din două subsecțiuni: medicamente imunobiologice și medicamente obținute din sânge și plasmă umană.
Anexele la Fondul de Stat al Federației Ruse ale ediției a XIII-a sunt prezentate prin tabele de referință: un tabel al maselor atomice, tabele alcool-golemetrice, un tabel al echivalenților izotonici ai medicamentelor pentru clorura de sodiu, un tabel al numărului de picături în 1 g și în 1 ml și greutatea unei picături de medicamente lichide la o temperatură de 20 ° C conform unui capmetru standard, desene ale spectrelor IR ale probelor standard de substanțe farmaceutice.
Din acest număr, pentru prima dată pentru Fondul de Stat al Federației Ruse a ediției a XIII-a, 102 OFS au fost dezvoltate și recomandate pentru aprobare, inclusiv 30 OFS pentru metodele de analiză, 5 OFS pentru formele de dozare și 12 OFS pentru metodele de determinare a produselor farmaceutice și indicatori tehnologici ai formelor de dozare, 2 OFS pentru materiile prime din plante medicinale și 3 OFS pentru metodele de analiză a acesteia, 7 OFS pentru grupurile de medicamente imunobiologice și 31 OFS pentru metodele de testare a acestora, 3 OFS pentru grupuri de medicamente din sânge și plasmă de sânge uman și animal, 9 OFS pentru metode de analiză a medicamentelor obținute din sânge și sânge plasmatic la oameni și animale.
În plus, pentru includerea în Farmacopeea de Stat a Federației Ruse a ediției a XIII-a, au fost pregătite pentru prima dată 17 monografii farmacopeice, inclusiv 4 PS pentru substanțe farmaceutice, 4 PS pentru materii prime pentru plante medicinale, 5 PS pentru medicamente imunobiologice și 4 PS pentru medicamente din sânge și plasmă umană ....
O serie de OFS, prezentate anterior în Farmacopeea de Stat din edițiile X și XI ale URSS (ediția GF URSS X, ediția GF URSS XI), sunt excluse din practica analizei farmacopeei moderne ca neprivate. Alte OFS și FS actuale ale ediției URSS GF X, ediția URSS GF XI (edițiile 1, 2) și Farmacopeea de Stat a Federației Ruse ediția XII (ediția RF GF XII) au fost revizuite și completate cu materiale luând în considerare cerințele moderne, realizări științifice și practice în domeniul analizei farmacopeei.
Monografia generală pentru farmacopee „Reguli pentru utilizarea monografiilor farmacopeei” a fost completată cu secțiunile „Umiditate” și „Depozitare”. În plus, s-au făcut clarificări corespunzătoare secțiunilor „Descriere”, „Greutate”, „Volum”, „Temperatură”, „Eșantion precis”, „Solvenți”, „Indicatori”, „Limite de conținut”, „Filtrare”.
În monografia generală a farmacopeei „Eșantionare”, au fost introduse definiții ale termenilor, dispoziții generale, iar secțiunea „Reguli de eșantionare” a fost completată. De asemenea, au fost introduse noi secțiuni: „Prelevarea de probe din medicamente și materiale în vrac
pescuit "," Prelevarea de probe medicamentoase în ambalaje pentru consumatori "," Ambalarea, etichetarea, depozitarea probelor selectate "," Cerințe pentru săli de prelevare, echipamente și personal. "
Monografia Generală a Farmacopeei „Analiza sitei” a fost elaborată în locul Monografiei generale a Farmacopeei a XI-a ediție „Determinarea fineții pulberilor și sitelor” și indică scopul analizei sitei, condițiile și metodele de desfășurare a acesteia, clasificarea tipicelor dimensiunile sitei în conformitate cu cerințele standardelor mondiale.
Noua ediție a Monografiei Generale a Farmacopeei „Sterilizare” conține metodele și condițiile actuale moderne pentru sterilizarea substanțelor farmaceutice, medicamente, excipienți etc., sunt date criteriul pentru nivelul de furnizare a sterilizării, caracteristicile indicatorilor biologici ai sterilizării.
În conformitate cu datele suplimentare privind toxicitatea din monografia generală a farmacopeei „Solvenți organici reziduali” s-au făcut clarificări și s-au adăugat informații despre solvenții cu toxicitate insuficient justificată.
În monografia generală pentru farmacopee „Radiofarmaceutice” a fost extinsă secțiunea „Lista indicatorilor de calitate la care trebuie să respecte radiofarmaceutice de producție industrială și fabricare extemporală”, iar secțiunea „Timp de înjumătățire” este completată de ecuația timpului de înjumătățire curba.
În OFS „Substanțe farmaceutice” au fost aduse adăugări semnificative la secțiunea care caracterizează cerințele privind calitatea substanțelor farmaceutice (de exemplu, „Solvenți organici reziduali”, „Endotoxine bacteriene sau pirogenitate” etc.). Este furnizată o definiție editată a termenului „substanță farmaceutică”. OFS este completat cu secțiuni privind metodele de analiză biologică: "Toxicitate anormală" și "Histamină și / sau substanțe depresive". Conține tabele precum „Limite de control, identificare și calificare a impurităților aferente pentru substanțele farmaceutice”, „Limite de control, identificare și calificare a impurităților aferente în peptide obținute prin mijloace sintetice” și „Criterii pentru standardizarea conținutului permis de metale grele ".
Monografia generală a farmacopeei „Perioada de valabilitate a medicamentelor” este completată cu secțiunea „Testele de stabilitate prin metoda„ îmbătrânirii accelerate ”.
Reacțiile generale la sistemul de divulgare generală a autenticității include în plus secțiunea „Aluminiu”, iar secțiunea „Seleniu” este adăugată la monografia generală a farmacopeei „Metoda de ardere într-un balon cu oxigen”.
Se continuă descrierea testelor pentru puritate și limitele admisibile de impurități în medicamente. Astfel, pentru prima dată sunt prezentate metode pentru determinarea impurităților de aluminiu, fosfați, mercur și seleniu. Metodele de determinare a impurităților de amoniu, calciu, arsenic, sulfați, cloruri și zinc și cerințele de reglementare pentru conținutul lor sunt armonizate cu cerințele standardelor mondiale. Monografia Generală a Farmacopeei „Metale grele” specifică suplimentar metode pentru determinarea cantitativă a ionilor individuali, iar Monografia Generală a Farmacopeei „Fier” conține clarificări privind concentrația reactivilor.
Se recomandă determinarea fluorului în medicamente prin trei metode: titrimetrică, spectrofotometrică și ionometrică.
În plus față de determinarea numărului de saponificare, acid, eter și iod, GF RF din ediția a XIII-a include monografia generală a farmacopeei dedicată determinării numărului de peroxizi, hidroxil și anizidină. Spre deosebire de valoarea peroxidului, numărul anizidinei caracterizează conținutul produselor de oxidare secundară (aldehide, cetone) din substanța farmaceutică testată și / sau produsul medicinal și oferă astfel o imagine completă a calității medicamentului analizat.
Monografia generală a farmacopeei „Determinarea proteinelor” a fost revizuită în mod semnificativ: structura articolului a fost modificată; O metodă precum determinarea proteinelor cu reactivul Nessler a fost exclusă - această metodă este inclusă într-o monografie generală separată a farmacopeei „Determinarea azotului proteic cu reactivul Nessler cu precipitarea preliminară a materialului proteic în medicamentele imunobiologice”.
Pentru a caracteriza principalul indicator al calității preparatelor antiacide, monografia generală a farmacopeei „Determinarea capacității de neutralizare a acidului” este inclusă pentru prima dată în Fondul farmaceutic de stat al Federației Ruse a ediției a XIII-a.
Metodele spectroscopice moderne pentru studierea structurii și calității medicamentelor sunt spectrometria Raman, spectrometria de fluorescență cu raze X, spectrometria în infraroșu apropiat, spectrometria în infraroșu, spectrofotometria ultravioletă și vizibilă, spectrometria cu emisii atomice, fluorimetria, spectroscopia magnetică nucleară. Rezonanța, spectrometria de masă etc. Luând în considerare capacitățile moderne ale metodelor spectroscopice, au fost dezvoltate pentru prima dată OFS precum "spectrometria Raman", "spectrometria de fluorescență cu raze X", "spectrometria de masă" și "spectrometria în regiunea infraroșu apropiat".
Necesitatea introducerii OFS „Polimorfism” și „Cristalinitate” se datorează relevanței evaluării polimorfismului și a gradului de cristalinitate sau a conținutului fracției amorfe din substanțele farmaceutice, care ulterior determină efectul terapeutic al medicamentelor, afectează semnificativ parametrii a biodisponibilității lor.
Monografia generală de farmacopee „Spectrometrie de emisie atomică și spectrometrie de absorbție atomică” ediția GF XII (partea 1) este împărțită în două monografii generale de farmacopee: „Spectrometrie de emisie atomică” și „Spectrometrie de absorbție atomică”. În următoarea ediție a Fondului de Stat al Federației Ruse, va fi prezentată o versiune revizuită și completată a CFS „Atomic Emission Spectrometry”.
În noua ediție a monografiei generale pentru farmacopee "Fluorimetrie", formularea definiției metodei a fost modificată către o concizie și versatilitate mai mare, substanțele farmaceutice pentru care este disponibilă această metodă de determinare, sunt descrise sursele de radiații excitante, conceptul schimbării Stokes este dat cu o scurtă justificare a motivului acestui fenomen, grupurile de compuși cu proprietăți fluorescente-
mi, lista factorilor care influențează intensitatea fluorescenței a fost completată.
Pentru prima dată, Farmacopeea de Stat include articole farmacopee generale „Microscopie optică” și „Determinarea distribuției mărimii particulelor prin difracția cu laser a luminii”. Spre deosebire de metoda microscopiei, metoda de studiere a sistemelor dispersate bazate pe împrăștierea luminii laser face posibilă evaluarea tuturor particulelor, este nedistructivă și permite măsurarea dimensiunii particulelor în intervalul de la 0,1 μm la 3 mm, spre deosebire de cea optică microscopie, care este utilizată pentru a caracteriza particulele cu o dimensiune de 1 microni și mai mult.
Pierderea de masă la uscare și determinarea apei sunt acoperite în două articole separate. În plus față de semi-lumikrometria lui K. Fischer, este descrisă o metodă coulometrică (micrometodă), care face posibilă determinarea cantitativă a cantităților de apă din medicamente.
În monografia generală a farmacopeei „Vâscozitatea” se modifică definiția lichidelor non-newtoniene, sunt caracterizate condițiile pentru determinarea vâscozității pe un viscozimetru rotativ. Următoarele subsecțiuni au fost adăugate ca altele noi: „Viscometre cu cilindru concentric (viscozimetre absolute)”, „Viscometre cu sistem plan con (viscozimetre absolute)” și „Viscometru cu fus (viscozimetre relative)”.
Dezvoltarea monografiei generale pentru farmacopee „Conductivitatea electrică” a fost cauzată de necesitatea includerii acestui indicator de calitate și a metodei pentru determinarea acestuia în FS „Apă purificată” și „Apă pentru injecții”.
Electroforeza este o alternativă sau complementară metodelor de testare cromatografică. La revizuirea electroforezei de farmacoforeză generală, sa acordat o atenție specială descrierii metodei de electroforeză a proteinelor din gelul de poliacrilamidă cu dodecil sulfat de sodiu, care este cel mai utilizat în analiza farmaceutică. Comparativ cu electroforeza tradițională, introducerea electroforezei capilare a făcut posibilă cuantificarea automată nu numai a moleculelor mari încărcate sau a microparticulelor, ci și a cationilor, anionilor și a compușilor neutri.
Electroforeza pe gel de poliacrilamidă este utilizată pe scară largă pentru separarea diferitelor proteine și estimarea greutății lor moleculare. Prin variația concentrației de poliacrilamidă din gel, gama de greutăți moleculare a proteinelor care trebuie separate poate fi controlată, ceea ce este foarte convenabil pentru a obține rezultate exacte. Fracționarea moleculelor de proteine folosind această metodă este utilizată pe scară largă pentru a controla calitatea medicamentelor de natură proteică.
Pentru prima dată, analiza elementară automată este introdusă în practica analizei farmacopee interne, ceea ce face posibilă simplificarea semnificativă a analizei compușilor organici care conțin azot, sulf, clor, brom, oxigen și alte elemente. Determinarea se bazează pe descompunerea oxidativă la temperaturi ridicate a substanțelor testate și determinarea selectivă ulterioară a produselor de descompunere corespunzătoare acestor elemente prin cromatografie în fază gazoasă. Unul dintre avantajele analizei elementare automate este capacitatea de a utiliza un eșantion standard cu un conținut cunoscut al elementului care urmează să fie determinat pentru a evalua calitatea diferitelor medicamente pentru acest element.
Determinarea activității de adsorbție a enterosorbanților este un indicator specific al calității acestei clase de medicamente. Activitatea de adsorbție este utilizată pentru a caracteriza capacitatea de absorbție a enterosorbanților; metodele pentru determinarea acesteia sunt reflectate în această compoziție farmaceutică generală.
Articolele incluse în GF RF a ediției a XIII-a a articolului care descrie metodele biologice de control al calității medicamentelor corespund abordării moderne a testării biologice. Monografia Generală a Farmacopeei „Endotoxinele bacteriene” introduce pentru prima dată o descriere a metodelor fotometrice pentru determinarea endotoxinelor bacteriene: turbidimetrică și cromogenă.
Din monografia generală a farmacopeei „Metode biologice pentru evaluarea activității materialelor vegetale medicinale și a produselor medicamentoase care conțin glicozide cardiace” în timpul revizuirii sale, a fost exclusă metoda de evaluare biologică a conținutului de glicozide cardiace, efectuată la pisici.
Monografia generală a farmacopeei „Puritatea microbiologică” a fost semnificativ îmbunătățită și completată cu noi secțiuni, inclusiv cele referitoare la cerințele pentru medicamentele imunobiologice.
Revizuirea monografiei generale a farmacopeei „Determinarea eficacității conservanților antimicrobieni” a făcut posibilă aducerea și clarificarea adecvată a acesteia cu privire la categoriile de medicamente care conțin conservanți și criteriile de evaluare a eficacității conservanților antimicrobieni pentru medicamente.
Revizuirea monografiei generale a farmacopeei „Reactivi. Indicatorii "au condus la o creștere semnificativă a listei de reactivi și indicatori utilizați în analiza farmacopeei. Denumirile chimice ale reactivilor și indicatorilor sunt date în conformitate cu cerințele Uniunii Internaționale de Chimie Pură și Aplicată (IUPAC). Sunt indicate numerele de înregistrare CAS (Chemical Abstracts Service) ale substanțelor chimice enumerate în Registrul Chemical Abstracts Service. S-au făcut rafinări și adăugiri la formulele chimice și parametrii fizici ai reactivilor și indicatorilor.
La revizuirea OFS „Prelucrarea statistică a rezultatelor unui experiment chimic și testele biologice” a fost împărțită în două OFS: „Prelucrarea statistică a rezultatelor unui experiment chimic” și „Prelucrarea statistică a rezultatelor determinării activității farmacologice specifice a medicamentelor prin metode biologice. "
Pentru prima dată în GF RF a ediției a XIII-a, au fost dezvoltate și incluse preparate farmaceutice generale precum „Forme de dozare”, „Forme de dozare pentru inhalare”, „Tencuieli transdermice”, „Soluții” și „Granule presate tăiate” .
Monografia generală pentru farmacopee „Formele de dozare” conține termeni și definiții de bază, clasificarea formelor de dozare, cerințe generale pentru producție / fabricație, evaluarea calității, ambalarea, etichetarea și depozitarea medicamentelor în forme de dozare adecvate. Această monografie generală de farmacopee conține indicatori de calitate care sunt obligatorii pentru evaluarea calității unui medicament sub orice formă de dozare, precum și indicatori de calitate care caracterizează caracteristicile producției / fabricării unui medicament și a substanțelor sale active și auxiliare.
17 OFS pentru formele de dozare au fost introduse pentru a înlocui articolele corespunzătoare din URSS GF din ediția a XI-a, cu introducerea de modificări și completări la acestea.
Majoritatea monografiilor generale de farmacopee privind metodele de evaluare a indicatorilor farmaceutici și tehnologici ai calității formelor de dozare sunt incluse pentru prima dată în Fondul de stat al Federației Ruse a ediției a XIII-a. S-au dezvoltat GPM-uri separate pentru metodele de analiză descrise anterior în articolele Farmacopeei de Stat XI privind formele de dozare (metode pentru determinarea volumului extractibil de forme de dozare pentru uz parenteral, abraziunea comprimatelor, timpul de deformare completă a supozitoarelor pe bază lipofilă, dezintegrarea tabletelor și capsulelor).
Pentru prima dată dezvoltat și inclus în ediția GF RF XIII a Monografiei generale a farmacopeei pentru astfel de metode pentru determinarea indicatorilor farmaceutici și tehnologici ai calității formelor de dozare ca „Incluziuni mecanice vizibile în formele de dozare pentru uz parenteral și formele de dozare oftalmice”, „Incluziuni mecanice invizibile în formele de dozare pentru uz parenteral”, „Masa (volumul) conținutului ambalajului”, „Uniformitatea dozelor”, „Uniformitatea masei formelor de dozare”, „Rezistența comprimatelor pentru zdrobire”, „Dezintegrarea supozitoarelor” și comprimate vaginale "," Dizolvarea pentru supozitoare pe bază lipofilă "," Gradul de pulberi de fluiditate "," Dizolvarea pentru plasturi transdermici ".
Subsecțiunea „Materii prime pentru plante medicinale și metode de analiză a acesteia” include 23 OFS și 55 FS. Cerințele pentru eșantionarea, depozitarea, ambalarea, etichetarea și transportul plantelor medicinale și al produselor medicinale pe bază de plante sunt prezentate în subsecțiunea „Articole generale” din Monografia generală a farmacopeei „Eșantionarea plantelor medicinale și a produselor medicinale pe bază de plante” „Și monografia generală a farmacopeei„ Ambalare , etichetarea și transportul plantelor medicinale și al produselor medicinale pe bază de plante. "
Cerințele generale pentru materiile prime medicinale pe bază de plante sunt stabilite în monografia generală a farmacopeei „Materii prime medicinale pe bază de plante”. 12 OFS sunt dedicate metodelor de analiză a plantelor medicinale și a produselor medicinale pe bază de plante. 8 OFS descrie cerințele pentru metodele de analiză a materiilor prime pentru plante medicinale în funcție de grupurile morfologice: flori, fructe, semințe, muguri, ierburi, frunze, scoarță și organe subterane. De asemenea, în această secțiune există 2 preparate farmaceutice generale pentru medicamente pe bază de plante: preparate farmaceutice generale „Uleiuri vegetale grase” și „uleiuri esențiale”.
Monografia generală a farmacopeei „Materii prime pentru plante medicinale” a fost elaborată și inclusă pentru prima dată în Fondul de stat al Federației Ruse. Acest articol oferă o clasificare a materialelor din plante medicinale în funcție de grupurile morfologice, finețe, conținutul unuia sau altui grup de substanțe biologic active, oferă principalii indicatori ai calității materialelor din plante medicinale și cerințele generale pentru depozitare și ambalare.
Din cele 12 OFS privind metodele de analiză a materiilor prime pentru plante medicinale, 3 OFS sunt incluse pentru prima dată în Fondul de stat al Federației Ruse din ediția a XIII-a, 9 OFS sunt revizuite și introduse pentru a înlocui articolele Fondului de stat al URSS a XI-a ediție. Pentru prima dată inclus în practica analizei farmacopeei interne: Monografia generală a farmacopeei „Determinarea conținutului de metale grele și arsen în materiile prime și plante medicinale pentru plante medicinale.
preparate ", monografie generală pentru farmacopee" Determinarea conținutului de pesticide reziduale în materii prime pentru plante medicinale și preparate pe bază de plante medicinale ", monografie generală pentru farmacopee" Determinarea coeficientului de absorbție a apei și a coeficientului de consum al materiilor prime pentru plante medicinale ".
GF RF din ediția a XIII-a include noi tipuri de materiale pentru plante medicinale aprobate pentru uz medical, cum ar fi fructe uscate de ardei iute, frunze de ginkgo biloba, iarbă de trifoi dulce și muguri de plop. Structura monografiilor farmacopeei pentru materiile prime ale plantelor medicinale este armonizată cu cerințele standardelor mondiale de farmacopee pentru materiile prime ale plantelor medicinale.
Subsecțiunea „Grupuri de medicamente imunobiologice și metode de analiză a acestora” include 43 OFS și 48 FS pentru medicamente imunobiologice.
IMP-urile includ vaccinuri, toxoizi, seruri și alergeni.
Pentru prima dată în practica analizei farmacopee interne, OFS au fost introduse pentru anumite grupuri de medicamente imunobiologice, cum ar fi „Tratamentul și bacteriofagii profilactici”, „Pro-biotice”, „Probiotice care conțin bifide”, „Coliform- care conțin probiotice "," probiotice care conțin lactice "," probiotice cu spori "și" medicamente obținute prin metode de ADN recombinant ".
Din 48 de FS pentru imunosorbenți incluși în Farmacopeea de Stat a Federației Ruse din ediția a XIII-a, 5 FS au fost dezvoltate pentru prima dată în practica analizei farmacopee interne: „Vaccin dizenteric împotriva lipopolizaharidei Shigella Zonne”, „Vaccinul cultural împotriva rubeolei vii”, „Vaccin inactivat împotriva variolei”, „Globulină imunogenă umană”. FS "Supozitoarele pirogenale, rectale" a fost dezvoltat pentru prima dată în practica analizei farmaceutice interne și mondiale.
Medicamentele din sânge și plasma sanguină a oamenilor și animalelor sunt reprezentate de 13 OFS și 8 FS.
Medicamentele din sânge și plasmă umană includ medicamente din albumina umană.
ka, preparate de imunoglobuline umane și preparate de factori de coagulare a sângelui care conțin unul dintre factorii de coagulare sau o combinație a acestora.
12 Monografii generale de farmacopee pentru medicamente din sânge și plasmă sanguină la oameni și animale sunt prezentate pentru prima dată în Fondul de stat al Federației Ruse din ediția a XIII-a.
În monografiile farmacopee pentru substanțe farmaceutice de origine sintetică și minerală, denumirile chimice ale substanțelor medicinale sunt date în conformitate cu cerințele Uniunii Internaționale de Chimie Teoretică și Aplicată (SHRAS), indicatorii de calitate, valorile lor normalizate și metodele corespunzătoare pentru analiza acestor indicatori.
Metoda spectrometriei în infraroșu, care oferă cel mai fiabil rezultat, este considerată principala metodă de identificare. Pentru o serie de substanțe, Anexa la Fondul de Stat al Federației Ruse din ediția XIII conține desene ale spectrelor IR ale probelor standard ale acestor substanțe farmaceutice.
Pentru determinarea cantitativă, se acordă preferință metodelor clasice de analiză titrimetrică. Odată cu aceasta, sunt utilizate pe scară largă metode moderne de analiză fizică și chimică, cum ar fi spectroscopia în regiunea ultravioletă, gazul și cromatografia lichidă de înaltă performanță, care implică utilizarea probelor standard. Conținutul substanței active este dat în termeni de substanță uscată (dacă se determină pierderea în greutate la uscare), anhidră (dacă se determină apa) sau o substanță anhidră care nu conține solvenți organici reziduali.
Astfel, introducerea OFS și FS pregătite pentru următoarea ediție a XIII-a a RF GF nu numai că va anula sau înlocui articolele învechite ale RF GF din edițiile anterioare, dar va asigura, de asemenea, că nivelul de analiză farmacopeică internă îndeplinește cerințele standardelor mondiale.
literatură
1. Farmacopeea de Stat a URSS. A 10-a ed. M.: Medicină; 1968.
2. Farmacopeea de Stat a URSS. Ediția a XI-a. Emisiune 1. M.: Medicină; 1987.
3. Farmacopeea de Stat a URSS. Ediția a XI-a. Emisiune 2. M.: Medicină; 1989.
4. Farmacopeea de Stat a Federației Ruse. A XII-a ed. Partea 1. Moscova: Centrul științific pentru expertiza produselor medicale; 2007.
Instituția bugetară federală de stat „Centrul științific pentru expertiza produselor medicamentoase” din Ministerul Sănătății al Federației Ruse. Federația Rusă, 127051, Moscova, Bulevardul Petrovsky, 8.
Merkulov Vadim Anatolievici. Primul director general adjunct, Dr. med. științe, profesor.
Elena I. Sakanyan. Director al Centrului pentru Farmacopee și Cooperare Internațională, Dr. Pharm. științe, profesor.
Shemeryankina Tatiana Borisovna. Șef al Departamentului de Stat al Farmacopeei și Analizei Farmacopeei, Cand. fermă. științe. Mochikina Olga Alekseevna. Cercetator al Departamentului de Farmacopee de Stat si Analiza Farmacopeei.
Bunyatyan Natalia Dmitrievna. Director general adjunct pentru cercetare, dr. Pharm. științe, profesor.
1. Farmacopeea de Stat a URSS. A 10-a ed. Moscova: Meditsina; 1968 (în rusă).
2. Farmacopeea de Stat a URSS. Ediția a XI-a. V. 1. Moscova: Meditsina; 1987 (în rusă).
3. Farmacopeea de Stat a URSS. Ediția a XI-a. V. 2. Moscova: Meditsina; 1989 (în rusă).
4. Farmacopeea de Stat a Federației Ruse. A 12-a ed. V. 1. Moscova: Instituția bugetară federală de stat „Centrul științific pentru evaluarea expertă a medicamentelor” al Ministerului Sănătății al Federației Ruse; 2007 (în rusă).
Instituția bugetară federală de stat „Centrul științific pentru evaluarea expertă a produselor medicamentoase” din Ministerul Sănătății al Federației Ruse, Bulevardul Petrovsky nr. 8, Moscova, 127051, Federația Rusă.
Merkulov VA. Primul director general adjunct. Doctor în științe medicale, profesor. Sakanyan EI. Director al Centrului pentru farmacopee și cooperare internațională. Doctor în științe farmaceutice, profesor.
Shemeryankina TB. Șef al Departamentului de Stat al Farmacopeei și analizei farmacopeei. Candidat la științe farmaceutice.
Mochikina OA. Cercetător al Departamentului de Farmacopee de Stat și de analiză a farmacopeei.
Bunyatyan ND. Director general adjunct pentru activitatea științifică. Doctor în științe farmaceutice, profesor.