Alkenlerin doğada oluşumu kısadır. Alkenlerin fiziksel özellikleri, uygulamaları, hazırlama yöntemleri
Alken hidrokarbonlar (olefinler), kendi özelliklerine sahip organik madde sınıflarından biridir. Bu sınıfın temsilcilerindeki alkenlerin izomerizm türleri, diğer organik maddelerin izomerizmi ile tekrarlanmamaktadır.
Temas halinde
Sınıfın özellikleri
Etilen olefinlere denir bir çift bağ içeren doymamış hidrokarbon sınıflarından biri.
Fiziksel özelliklere göre, bu doymamış bileşik kategorisinin temsilcileri şunlardır:
- gazlar,
- sıvılar,
- katı bileşikler.
Moleküller sadece bir “sigma” bağı değil, aynı zamanda bir “pi” bağı da içerir. Bunun nedeni ise hibritleşmenin yapısal formülünün varlığıdır” sp2"bileşiğin atomlarının aynı düzlemde düzenlenmesi ile karakterize edilir.
Bu durumda aralarında en az yüz yirmi derecelik bir açı oluşur. Hibritleşmemiş yörüngeler " R» Hem moleküler düzlemin üstünde hem de altındaki konumuyla karakterize edilir.
Bu yapısal özellik ek bağların oluşumuna yol açar - “pi” veya “ π ».
Açıklanan bağ, "sigma" bağlarına kıyasla daha az güçlüdür çünkü yanlara doğru üst üste binme zayıf bir yapışmaya sahiptir. Oluşan bağların elektron yoğunluklarının toplam dağılımı heterojenlik ile karakterize edilir. Bir karbon-karbon bağının yakınında dönerken, "p" yörüngelerinin üst üste binmesi bozulur. Her alken (olefin) için bu model ayırt edici bir özelliktir.
Neredeyse tüm etilen bileşikleri, tüm organik maddelerin özelliği olmayan yüksek kaynama ve erime noktalarına sahiptir. Bu doymamış karbonhidrat sınıfının temsilcileri diğer organik çözücülerde hızla çözünür.
Dikkat! Asiklik doymamış bileşikler, etilen hidrokarbonlar, - CnH2n genel formülüne sahiptir.
Homoloji
Alkenlerin genel formülü CnH2n olduğundan belli bir homolojiye sahiptirler. Alkenlerin homolog serisi ilk temsilci olan etilen veya eten ile başlar. Bu madde normal koşullar altında bir gazdır ve iki karbon atomu ve dört hidrojen atomu içerir.C2H4. Etenden sonra alkenlerin homolog serisi propen ve büten ile devam eder. Formülleri şu şekildedir: “C3H6” ve “C4H8”. Normal şartlarda bunlar da daha ağır gazlardır, yani ters çevrilmiş bir test tüpüyle toplanmaları gerekir.
 Alkenlerin genel formülü, yapısal zincirde en az beş karbon atomuna sahip olan bu sınıfın bir sonraki temsilcisini hesaplamamızı sağlar. Bu, "C5H10" formülüne sahip bir pentendir.
Alkenlerin genel formülü, yapısal zincirde en az beş karbon atomuna sahip olan bu sınıfın bir sonraki temsilcisini hesaplamamızı sağlar. Bu, "C5H10" formülüne sahip bir pentendir.
İle fiziksel özellikler belirtilen madde sıvılara ve ayrıca homolog çizginin aşağıdaki on iki bileşiğine aittir.
Bu özelliklere sahip alkenler arasında C 18 H 36 formülüyle başlayan katılar da vardır. Sıvı ve katı etilen hidrokarbonlar suda çözünmezler ancak organik çözücülere girdiklerinde onlarla reaksiyona girerler.
Açıklanan genel alken formülü, daha önce kullanılan "an" son ekinin "en" ile değiştirilmesini ima eder. Bu, IUPAC kurallarında yer almaktadır. Bu bileşik kategorisinin hangi temsilcisini alırsak alalım, hepsi açıklanan son eke sahiptir.
Etilen bileşiklerinin adları her zaman formüldeki çift bağın yerini gösteren belirli bir sayı içerir. Bunun örnekleri: “büten-1” veya “penten-2”. Atomik numaralandırma, çift konfigürasyonun en yakın olduğu kenardan başlar. Bu kural her durumda “demir”dir.
İzomerizm
Alkenlerin hibridizasyon türüne bağlı olarak, her biri kendine has özelliklere ve yapıya sahip olan belirli izomerizm türleri ile karakterize edilirler. Alkenlerin ana izomerizm türlerini ele alalım.
Yapısal tip
Yapısal izomerizm aşağıdakilere göre izomerlere ayrılır:
- karbon iskeleti;
- çift bağın yeri.
Karbon iskeletinin yapısal izomerleri, radikaller (ana zincirden dallar) ortaya çıktığında ortaya çıkar.
Belirtilen izomerizmin alkenlerinin izomerleri şöyle olacaktır:
CH2 =CH — CH 2 — CH 3.
2-metilpropen-1:
CH2 =C — CH 3
│
Sunulan bileşikler ortak sayıda karbon ve hidrojen atomuna (C4H8) sahiptir, ancak hidrokarbon iskeletinin farklı bir yapısı vardır. Bunlar, özellikleri aynı olmasa da yapısal izomerlerdir. Butene-1 (butilen), solunum yollarını tahriş eden karakteristik bir kokuya ve narkotik özelliklere sahiptir. 2-metilpropen-1 bu özelliklere sahip değildir.
İÇİNDE bu durumda Etilenin (C2H4) izomerleri yoktur, çünkü radikallerin ikame edilemediği yalnızca iki karbon atomundan oluşur.
Tavsiye! Radikalin orta ve sondan bir önceki karbon atomlarına yerleştirilmesine izin verilir, ancak bunların uçtaki ikame edicilerin yakınına yerleştirilmesine izin verilmez. Bu kural tüm doymamış hidrokarbonlar için çalışır.
Çift bağın konumuna bağlı olarak izomerler ayırt edilir:
CH2 =CH — CH 2 — CH2-CH3.
CH3-CH = CH — CH2-CH3.
Sunulan örneklerdeki alkenlerin genel formülü şöyledir:C5H10,ancak bir çift bağın yeri farklıdır. Bu bileşiklerin özellikleri farklılık gösterecektir. Bu yapısal izomerizmdir.

İzomerizm
Uzamsal tip
Alkenlerin uzaysal izomerizmi, hidrokarbon ikame edicilerinin düzeninin doğasıyla ilişkilidir.
Buna dayanarak izomerler ayırt edilir:
- "Cis";
- "Trans".
Alkenlerin genel formülü, aynı bileşiğin "trans izomerlerinin" ve "cis izomerlerinin" oluşturulmasına izin verir. Örneğin butileni (buten) ele alalım. Bunun için ikame edicileri çift bağa göre farklı şekilde konumlandırarak uzaysal yapıya sahip izomerler oluşturmak mümkündür. Örneklerle alkenlerin izomerizmi şöyle görünecektir:
"cis-izomer" "trans-izomer"

Buten-2 Buten-2
İtibaren yukarıdaki örnek"Cis-izomerlerin" çift bağ düzleminin bir tarafında iki özdeş radikale sahip olduğu görülebilir. "Trans-izomerler" için bu kural işe yaramaz çünkü "C=C" karbon zincirine göre konumlandırılmış iki farklı ikame ediciye sahiptirler. Bu modeli göz önünde bulundurarak çeşitli asiklik etilen hidrokarbonlar için "cis" ve "trans" izomerlerini kendiniz oluşturabilirsiniz.
Büten-2 için sunulan "cis izomeri" ve "trans izomeri", mevcut karbon çift zincirinin (C=C) etrafında dönmeyi gerektirdiğinden birbirine dönüştürülemez. Bu dönüşü gerçekleştirmek için mevcut “p-bağının” kırılması için belirli bir miktarda enerjiye ihtiyaç vardır.
Yukarıdakilerin hepsine dayanarak, "trans" ve "cis" izomerlerinin belirli kimyasal ve fiziksel özelliklere sahip ayrı bileşikler olduğu sonucuna varabiliriz.
Hangi alkenin izomeri yoktur? Etilen, çift zincire göre hidrojen ikame edicilerinin aynı düzenlemesi nedeniyle uzaysal izomerlere sahip değildir.
Sınıflar arası
Alken hidrokarbonlarda sınıflar arası izomerizm yaygındır. Bunun nedeni benzerlik Genel formül sikloparafinler (sikloalkanlar) formülüne sahip bu sınıfın temsilcileri. Bu madde kategorileri aynı sayıda karbon ve hidrojen atomuna sahiptir; bu da bileşimin bir katıdır (CnH2n).
Sınıflar arası izomerler şöyle görünecek:
CH2 =CH — CH 3.
Siklopropan:
Formülün olduğu ortaya çıktıC3H6İki bileşik cevap veriyor: propen-1 ve siklopropan. Yapısal yapı, karbonun birbirine göre farklı düzenini gösterir. Bu bileşiklerin özellikleri de farklıdır. Propen-1 (propilen), düşük kaynama noktasına sahip gaz halinde bir bileşiktir. Siklopropan için tipiktir gaz hali keskin bir kokuya ve buruk bir tada sahiptir. Kimyasal özellikler Bu maddeler de farklıdır ancak bileşimleri aynıdır. Organikte bu tip izomerlere sınıflar arası denir.
Alkenler. Alkenlerin izomerizmi. Birleşik Devlet Sınavı. Organik Kimya.
Alkenler: Yapı, isimlendirme, izomerizm
Çözüm
Alken izomerizmi onların önemli karakteristik Doğada farklı özelliklere sahip, endüstride ve günlük yaşamda uygulama alanı bulan yeni bileşiklerin ortaya çıkması sayesinde.
ETİLEN SERİSİNİN DOYMAMIŞ VEYA DOYMAMIŞ HİDROKARBONLARI
(ALKENLER VEYA OLEFİNLER)
Alkenler, veya olefinler(Latince olefiant - yağ - eski bir isimdir, ancak kimya literatüründe yaygın olarak kullanılmaktadır. Bu ismin nedeni 18. yüzyılda elde edilen etilen klorür sıvı, yağlı bir maddedir.) - Moleküllerinde karbon atomları arasında bir çift bağ bulunan alifatik doymamış hidrokarbonlar.
Alkenler, moleküllerinde karşılık gelen alkanlardan (aynı sayıda karbon atomuna sahip) daha az hidrojen atomu içerir, bu nedenle bu tür hidrokarbonlara denir. sınırsız veya doymamış.
Alkenler genel formülle homolog bir seri oluşturur CnH2n
1. Homolog alken serileri
|
İLE nH2n alken |
İsimler, sonek EH, İLEN |
|
C2H4 |
Bu tr, Bu Ilen |
|
C3H6 |
propen |
|
C4H8 |
büten |
|
C5H10 |
penten |
|
C6H12 |
heksen |
Homologlar:
İLEH 2 = CH 2 eten
İLEH 2 = CH- CH 3 propen
İLEH2 =CH-CH2-CH3büten-1
İLEH2 =CH-CH2-CH2 -CH 3 penten-1
Etilen (eten), çok hafif tatlımsı bir kokuya sahip, havadan biraz daha hafif, suda az çözünür, renksiz bir gazdır.
C 2 – C 4 (gazlar)
C 5 – C 17 (sıvılar)
C 18 – (katı)
· Alkenler suda çözünmez, organik çözücülerde (benzin, benzen vb.) çözünür.
Sudan daha hafif
Mr arttıkça erime ve kaynama noktaları artar
3. En basit alken etilen - C2H4
Etilenin yapısal ve elektronik formülleri şunlardır:
Etilen molekülünde hibridizasyona uğrar S- ve iki P-C atomlarının yörüngeleri ( sp 2 -hibridizasyon).
Böylece, her C atomunun üç hibrit yörüngesi ve bir hibrit olmayan yörüngesi vardır. P-orbitaller. C atomlarının hibrit yörüngelerinden ikisi karşılıklı olarak örtüşür ve C atomları arasında oluşur
σ - bağ. C atomlarının geri kalan dört hibrit yörüngesi aynı düzlemde dört ile örtüşmektedir. S H atomlarının -orbitalleri ve ayrıca dört σ - bağı oluşturur. Hibrit olmayan iki P C atomlarının -orbitalleri, σ-bağ düzlemine dik olarak konumlandırılmış bir düzlemde karşılıklı olarak örtüşür; bir tane oluştu P- bağlantı.

Doğası gereği P- bağlantı σ - bağlantıdan oldukça farklıdır; P- Molekül düzleminin dışındaki elektron bulutlarının örtüşmesi nedeniyle bağ daha az güçlüdür. Reaktiflerin etkisi altında P- bağlantı kolayca kopar.
Etilen molekülü simetriktir; tüm atomların çekirdekleri aynı düzlemde bulunur ve bağ açıları 120°'ye yakındır; C atomlarının merkezleri arasındaki mesafe 0,134 nm'dir.
Atomlar çift bağla bağlıysa, elektron bulutları olmadan dönmeleri imkansızdır. P- bağlantı açılmadı.
4. Alkenlerin izomerizmi
İle birlikte karbon iskeletinin yapısal izomerizmi Alkenler öncelikle diğer yapısal izomerizm türleri ile karakterize edilir - çoklu bağ pozisyonu izomerizmi Ve sınıflar arası izomerizm.
İkincisi, alken dizisinde uzaysal izomerizm , etrafında molekül içi dönmenin imkansız olduğu, çift bağa göre ikame edicilerin farklı konumlarıyla ilişkilidir.
Alkenlerin yapısal izomerizmi
1. Karbon iskeletinin izomerizmi (C 4 H 8'den başlayarak):
2. Çift bağın pozisyonunun izomerizmi (C4H8'den başlayarak):
3. C3H6 ile başlayan sikloalkanlarla sınıflar arası izomerizm:
Alkenlerin uzaysal izomerizmi
Atomların bir çift bağ etrafında dönmesi, onu kırmadan mümkün değildir. Bunun nedeni, p-bağının yapısal özelliklerinden kaynaklanmaktadır (p-elektron bulutu, molekül düzleminin üstünde ve altında yoğunlaşmıştır). Atomların katı sabitlenmesi nedeniyle çift bağa göre dönme izomerliği görülmez. Ama mümkün oluyor cis-trans-izomerizm.
Çift bağdaki iki karbon atomunun her birinde farklı ikame edicilere sahip olan alkenler, ikame edicilerin p-bağ düzlemine göre konumu farklı olan iki uzaysal izomer formunda mevcut olabilir. Yani, buten-2 molekülünde CH3 –CH=CH–CH3 CH3 grupları çift bağın bir tarafında bulunabilir. cis-izomer veya zıt taraflarda trans-izomer.

DİKKAT!
cis-trans- Çift bağdaki C atomlarından en az birinin 2 aynı ikame ediciye sahip olması durumunda izomerizm ortaya çıkmaz.
Örneğin,
buten-1 CH 2 = CH – CH 2 – CH 3 sahip değil cis- Ve trans-izomerler, çünkü 1. C atomu iki özdeş H atomuna bağlanır.
İzomerler cis- Ve trans- sadece fiziksel olarak farklı değil
 ,
,
ama aynı zamanda kimyasal özellikler, çünkü Bir molekülün parçalarının uzayda birbirine yakınlaştırılması veya uzaklaştırılması kimyasal etkileşimi teşvik eder veya engeller.
Bazen cis-trans-izomerizm tam olarak doğru olarak adlandırılmaz geometrik izomerizm. Yanlışlık şudur Tüm uzaysal izomerler geometrileri bakımından farklılık gösterir ve yalnızca cis- Ve trans-.
5. İsimlendirme
Basit yapıya sahip alkenler genellikle alkanlardaki -an ekinin yerine son ek getirilerek adlandırılır. -ilen: etan - etilen, propan - propilen vb.
Sistematik isimlendirmeye göre, etilen hidrokarbonların isimleri, karşılık gelen alkanlardaki -an ekinin -en ekiyle değiştirilmesiyle yapılır (alkan - alken, etan - eten, propan - propen, vb.). Ana zincirin seçimi ve adlandırma sırası alkanlarla aynıdır. Ancak zincirin mutlaka bir çift bağ içermesi gerekir. Zincirin numaralandırılması bu bağlantının en yakın olduğu uçtan başlar. Örneğin:

Doymamış (alken) radikaller önemsiz isimlerle veya sistematik isimlendirmeyle adlandırılır:
(H2C=CH-)vinil veya etenil
(H2C=CH-CH2) alil
Ders konusu: Alkenler. Alkenlerin hazırlanışı, kimyasal özellikleri ve uygulamaları.
Dersin amaçları ve hedefleri:
- etilenin spesifik kimyasal özelliklerini göz önünde bulundurun ve Genel Özellikler alkenler;
- ?-bağlantı, mekanizma kavramlarını derinleştirin ve somutlaştırın kimyasal reaksiyonlar;
- polimerizasyon reaksiyonları ve polimerlerin yapısı hakkında ilk fikirleri vermek;
- alken üretimine yönelik laboratuvar ve genel endüstriyel yöntemleri analiz etmek;
- Ders kitabıyla çalışma yeteneğini geliştirmeye devam edin.
Teçhizat: gaz üretmek için cihaz, KMnO 4 çözeltisi, etil alkol, konsantre sülfürik asit, kibritler, alkol lambası, kum, tablolar “Etilen molekülünün yapısı”, “Alkenlerin temel kimyasal özellikleri”, gösteri örnekleri “Polimerler”.
DERSLER SIRASINDA
I. Organizasyon anı
Homolog alken serilerini incelemeye devam ediyoruz. Bugün alkenlerin hazırlanma yöntemlerine, kimyasal özelliklerine ve uygulamalarına bakmalıyız. Çift bağın neden olduğu kimyasal özellikleri karakterize etmeli, polimerizasyon reaksiyonları hakkında ilk bilgileri edinmeli ve alken üretimi için laboratuvar ve endüstriyel yöntemleri dikkate almalıyız.
II. Öğrencilerin bilgilerini harekete geçirmek
- Hangi hidrokarbonlara alken denir?
- Yapılarının özellikleri nelerdir?
- Bir alken molekülünde çift bağ oluşturan karbon atomları hangi hibrit durumdadır?
Sonuç olarak: alkenler, moleküllerinde bir çift bağ bulunması nedeniyle alkanlardan farklıdır; bu, alkenlerin kimyasal özelliklerinin özelliklerini, bunların hazırlanma ve kullanım yöntemlerini belirler.
III. Yeni materyal öğrenme
1. Alken üretme yöntemleri
Alken üretme yöntemlerini doğrulayan reaksiyon denklemlerini oluşturun
– alkanların çatlaması C 8 H 18 ––> C 4 H 8 + C4H10; (400-700 o C'de termal çatlama)
oktan büten bütan
– C4H10 ––> C4H8 + H2 alkanlarının dehidrojenasyonu; (t, Ni)
bütan büten hidrojen
– haloalkanların dehidrohalojenasyonu C4H9Cl + KOH ––> C4H8 + KCl + H2O;
klorobütan hidroksit büten klorür su
potasyum potasyum
– dihaloalkanların dehidrohalojenasyonu 
– alkollerin dehidrasyonu C 2 H 5 OH ––> C 2 H 4 + H 2 O (konsantre sülfürik asit varlığında ısıtıldığında)
Hatırlamak!
Dehidrojenasyon, dehidrasyon, dehidrohalojenasyon ve dehalojenasyon reaksiyonlarında, hidrojenin tercihen daha az hidrojenlenmiş karbon atomlarından soyutlandığı unutulmamalıdır (Zaitsev kuralı, 1875)
2. Alkenlerin kimyasal özellikleri
Karbon-karbon bağının doğası, hangi kimyasal reaksiyonların tipini belirler? organik madde. Etilen hidrokarbon moleküllerinde çift karbon-karbon bağının varlığı, bu bileşiklerin aşağıdaki özelliklerini belirler:
– çift bağın varlığı alkenlerin doymamış bileşikler olarak sınıflandırılmasına izin verir. Doymuş olanlara dönüşmeleri ancak olefinlerin kimyasal davranışının temel özelliği olan ilave reaksiyonların bir sonucu olarak mümkündür;
– çift bağ önemli bir elektron yoğunluğu konsantrasyonunu temsil eder, bu nedenle ekleme reaksiyonları doğası gereği elektrofiliktir;
– bir çift bağ, oldukça kolay bir şekilde polarize olan bir ve bir bağdan oluşur.
Alkenlerin kimyasal özelliklerini karakterize eden reaksiyon denklemleri
a) İlave reaksiyonları
Hatırlamak! İkame reaksiyonları, yalnızca tek bağa sahip olan alkanların ve daha yüksek sikloalkanların karakteristiğidir; ekleme reaksiyonları, çift ve üçlü bağa sahip olan alkenlerin, dienlerin ve alkinlerin karakteristiğidir.

Hatırlamak! -Bağı kırmak için aşağıdaki mekanizmalar mümkündür:
a) alkenler ve reaktif polar olmayan bileşikler ise -bağı kırılarak bir serbest radikal oluşur:
H 2 C = CH 2 + H: H ––> + +
b) alken ve reaktif polar bileşikler ise, o zaman -bağın bölünmesi iyon oluşumuna yol açar:
c) molekülde hidrojen atomları içeren reaktifler kopan bağ bölgesinde birleştiğinde, hidrojen her zaman daha hidrojenlenmiş bir karbon atomuna bağlanır (Morkovnikov kuralı, 1869).
– polimerizasyon reaksiyonu nCH2 = CH2 ––> n – CH2 – CH2 –– > (– CH2 – CH2 –)n
eten polietilen
b) oksidasyon reaksiyonu
Laboratuvar deneyimi. Etilen elde edin ve özelliklerini inceleyin (öğrenci masalarındaki talimatlar)
Etilen elde etme talimatları ve onunla yapılan deneyler
1. Bir test tüpüne 2 ml konsantre sülfürik asit, 1 ml alkol ve az miktarda kum koyun.
2. Test tüpünü gaz çıkış tüpü olan bir tıpa ile kapatın ve alkol lambasının alevinde ısıtın.
3. Açığa çıkan gazı potasyum permanganat içeren bir çözeltiden geçirin. Çözeltinin rengindeki değişikliğe dikkat edin.
4. Gaz çıkış borusunun ucundaki gazı yakın. Alevin rengine dikkat edin.
– alkenler parlak bir alevle yanar. (Neden?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (tam oksidasyonla reaksiyon ürünleri karbondioksit ve sudur)
Kalitatif reaksiyon: “hafif oksidasyon (sulu çözeltide)”
– alkenler bir potasyum permanganat çözeltisinin rengini giderir (Wagner reaksiyonu)
Asidik bir ortamda daha şiddetli koşullar altında reaksiyon ürünleri, örneğin karboksilik asitler olabilir (asitlerin varlığında):
CH3 – CH = CH2 + 4 [O] ––> CH3COOH + HCOOH
– katalitik oksidasyon
Ana şeyi hatırla!
1. Doymamış hidrokarbonlar ilave reaksiyonlara aktif olarak katılırlar.
2. Alkenlerin reaktivitesi, reaktiflerin etkisi altında bağın kolayca kırılmasından kaynaklanmaktadır.
3. Ekleme sonucunda karbon atomlarının sp2'den sp3'e (hibrit durum) geçişi meydana gelir. Reaksiyon ürünü sınırlayıcı bir karaktere sahiptir.
4. Etilen, propilen ve diğer alkenler basınç altında veya bir katalizör varlığında ısıtıldığında, tek tek molekülleri uzun zincirler - polimerler halinde birleştirilir. Polimerler (polietilen, polipropilen) büyük pratik öneme sahiptir.
3. Alkenlerin uygulanması(aşağıdaki plana göre öğrenci mesajı).
1 – yüksek oktan sayısına sahip yakıt üretimi;
2 – plastikler;
3 – patlayıcılar;
4 – antifriz;
5 – çözücüler;
6 – meyve olgunlaşmasını hızlandırmak için;
7 – asetaldehit üretimi;
8 – sentetik kauçuk.
III. Öğrenilen materyalin pekiştirilmesi

Ev ödevi:§§ 15, 16, eski. 1, 2, 3 s.90, örn. 4, 5 s.95.
Düşük alkenler (C2 - C5), petrol ve petrol ürünlerinin ısıl işlemi sırasında oluşan gazlardan endüstriyel ölçekte üretilir. Alkenler laboratuvar sentez yöntemleri kullanılarak da hazırlanabilir.
4.5.1. Dehidrohalojenasyon
Haloalkanlar, susuz çözücüler içindeki bazlarla (örneğin alkollü bir potasyum hidroksit çözeltisi) işlendiğinde hidrojen halojenür elimine edilir.
4.5.2. Dehidrasyon
Alkoller sülfürik veya fosforik asitlerle ısıtıldığında molekül içi dehidrasyon meydana gelir. - eliminasyon).
Reaksiyonun baskın yönü, dehidrohalojenasyon durumunda olduğu gibi, en kararlı alkenin oluşumudur (Zaitsev kuralı).
Alkollerin dehidrasyonu, alkol buharının 300 - 350 o C'de bir katalizör (alüminyum veya toryum oksitler) üzerinden geçirilmesiyle gerçekleştirilebilir.
4.5.3. Komşu dihalojenürlerin halojensizleştirilmesi
Alkoldeki çinkonun etkisiyle, komşu atomlarda (visinal) halojen içeren dibromürler alkenlere dönüştürülebilir.

4.5.4. Alkinlerin hidrojenasyonu
Alkinler, az miktarda kurşun bileşiğinin (katalitik zehir) eklenmesiyle aktivitesi azaltılan platin veya nikel katalizörlerinin varlığında hidrojenlendiğinde, daha fazla indirgenmeye uğramayan bir alken oluşur.
4.5.5. Aldehitlerin ve ketonların indirgeyici kombinasyonu
İki aldehit veya keton molekülünden lityum alüminyum hidrit ve titanyum (III) klorür ile işlendiğinde iyi çıkışlar Sırasıyla di- veya tetra-ikame edilmiş alkenler oluşturulur.

5. alkin
Alkinler, üçlü karbon-karbon bağı –СС– içeren hidrokarbonlardır.
Basit alkinlerin genel formülü CnH2n-2'dir. Alkin sınıfının en basit temsilcisi asetilen H–СС–H'dir, bu nedenle alkinlere asetilen hidrokarbonlar da denir.
5.1. Asetilenin yapısı
Asetilenin karbon atomları sp- hibrit durum. Böyle bir atomun yörünge konfigürasyonunu gösterelim. Hibridizasyon sırasında 2'ler-orbitaller ve 2p-orbitaller iki eşit parçaya dönüşür sp- Hibrit yörüngeler aynı düz çizgi üzerinde yer alır ve geriye iki melezleşmemiş yörünge kalır R-orbitaller.

Pirinç. 5.1 Şemaformasyonsp -karbon atomunun hibrit yörüngeleri
Yörüngelerin yönleri ve şekilleri SR-melezleştirilmiş karbon atomu: melezleşmiş yörüngeler eşdeğerdir ve birbirlerinden maksimum derecede uzaktır
Asetilen molekülünde tek bir bağ vardır ( - karbon atomları arasındaki bağ, iki atomun üst üste gelmesiyle oluşur sp-melezleşmiş yörüngeler. Birbirine dik iki - iki çift melezleşmemiş çift yanal olarak üst üste bindiğinde bağlar ortaya çıkar 2p- yörüngeler, - Elektron bulutları iskeleti kaplar, böylece elektron bulutu silindire yakın bir simetriye sahip olur. Hidrojen atomlarıyla bağlar oluşur sp-karbon atomunun hibrit yörüngeleri ve 1 S-Hidrojen atomunun yörüngeleri, asetilen molekülü doğrusaldır.

Pirinç. 5.2 Asetilen molekülü
a - yanal örtüşme 2p iki yörünge verir - iletişim;
b - molekül doğrusaldır, -bulutun silindirik bir şekli vardır
Propinde basit bir bağlantı vardır ( - ile iletişim sp-İLE sp3 benzer bir bağlantıdan daha kısa C sp-İLE sp2 alkenlerde bu durum şu şekilde açıklanmaktadır: sp- Orbital çekirdeğe daha yakındır sp 2 - yörünge .
Karbon-karbon üçlü bağı C C, çift bağdan daha kısadır ve üçlü bağın toplam enerjisi yaklaşık olarak tek bir C-C bağı (347 kJ/mol) ve iki bağının enerjilerinin toplamına eşittir. (259 2 kJ/mol) (Tablo 5.1).
Alkenler öncelikle reaksiyonlarla karakterize edilir. katılım bir çift bağ aracılığıyla. Temel olarak bu reaksiyonlar iyonik bir mekanizma ile ilerler. Pi bağı kırılır ve iki yeni sigma bağı oluşur. Yer değiştirme reaksiyonlarının alkanlar için tipik olduğunu ve radikal bir mekanizma izlediğini hatırlatmak isterim. Hidrojen molekülleri alkenlere bağlanabilir; bu reaksiyonlara hidrojenasyon, su molekülleri, hidrasyon, halojenlerin halojenasyonu, hidrojen halojenürlerin hidrohalojenasyonu denir. Ama önce ilk şeyler.
Çift bağ katılma reaksiyonları
Bu yüzden, Birinci Hidrojen halojenürler ekleme kimyasal özelliği, hidrohalojenasyon.
Propen ve diğer alkenler, Markovnikov kuralına göre hidrojen halojenürlerle reaksiyona girer.

Bir hidrojen atomu, en fazla hidrojenlenmiş veya daha doğrusu hidrojenlenmiş karbon atomuna bağlanır.
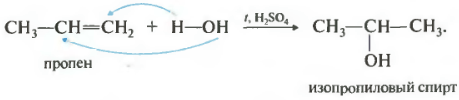
SaniyeÖzellikler listemizdeki numara hidrasyon, yani su eklenmesi olacaktır.
Reaksiyon, genellikle sülfürik veya fosforik bir asit varlığında ısıtıldığında gerçekleşir. Su ilavesi de Markovnikov kuralına göre gerçekleşir, yani birincil alkol yalnızca etilenin hidrasyonuyla elde edilebilir, kalan dallanmamış alkenler ikincil alkoller verir.
Hem hidrohalojenasyon hem de hidrasyon için Markovnikov kuralının istisnaları vardır. İlk olarak, bu kuralın aksine, ekleme peroksitlerin varlığında meydana gelir.
İkincisi, elektron çekici grupların mevcut olduğu alken türevleri için. Örneğin 3,3,3-trifloropropen-1 için.

Flor atomları, yüksek elektronegatiflikleri nedeniyle, bir sigma bağları zinciri boyunca elektron yoğunluğunu kendilerine çeker. Bu olguya negatif endüktif etki denir.

Bu nedenle, çift bağın hareketli pi elektronları yer değiştirir ve en dıştaki karbon atomu, genellikle delta artı olarak adlandırılan kısmi bir pozitif yük ile sonuçlanır. Negatif yüklü brom iyonu buna gidecek ve hidrojen katyonu en az hidrojenlenmiş karbon atomuna bağlanacaktır.
Triflorometil grubuna ek olarak, örneğin triklorometil grubu, nitro grubu, karboksil grubu ve diğer bazılarının negatif endüktif etkisi vardır.
Birleşik Devlet Sınavında Markovnikov kuralının bu ikinci ihlali durumu çok nadirdir, ancak sınavı maksimum puanla geçmeyi planlıyorsanız yine de bunu aklınızda bulundurmanız önerilir.
Üçüncü Halojen moleküllerinin kimyasal özellik bağlanması.

Bu reaksiyon çoklu bağ için niteliksel olduğundan, bu öncelikle bromla ilgilidir. Örneğin etileni bromlu sudan geçirirken, yani sudaki bir brom çözeltisi kahverengi renk rengi bozulur. Etan ve eten gibi bir gaz karışımını bromlu sudan geçirirseniz, reaksiyon şişesinde sıvı olan dibromoetan formunda kalacağı için eten safsızlıkları olmadan saf etan elde edebilirsiniz.
Gaz fazındaki alkenlerin güçlü ısıtmayla, örneğin klorla reaksiyonu özellikle dikkat çekicidir.
Bu koşullar altında meydana gelen bir ekleme reaksiyonu değil, bir ikame reaksiyonudur. Üstelik yalnızca alfa karbon atomunda, yani çift bağa bitişik atomda. Bu durumda 3-kloropropen-1 elde edilir. Bu tepkiler sınavda nadir olduğundan çoğu öğrenci bunları hatırlamaz ve kural olarak hata yapar.
Dördüncü sayısı hidrojenasyon reaksiyonu ve onunla birlikte dehidrojenasyon reaksiyonudur. Yani hidrojenin eklenmesi veya çıkarılması.

Hidrojenasyon çok fazla gerçekleşmez Yüksek sıcaklık nikel katalizörü üzerinde. Daha yüksek sıcaklıklarda alkinlerin üretilmesi için dehidrojenasyon mümkündür.
Beşinci Alkenlerin bir özelliği, yüzlerce ve binlerce alken molekülünün, pi bağının kırılması ve birbirleriyle sigma bağlarının oluşması nedeniyle çok uzun ve güçlü zincirler oluşturduğunda polimerleşme yeteneğidir.
Bu durumda sonuç polietilendi. Ortaya çıkan molekülün çoklu bağ içermediğini lütfen unutmayın. Bu tür maddelere polimer denir, orijinal moleküllere monomer denir, tekrarlanan parça polimerin temel birimidir ve n sayısı polimerizasyon derecesidir.
Diğer önemli sonuçları doğuran reaksiyonlar polimer malzemelerörneğin polipropilen.


Bir diğer önemli polimer ise polivinil klorürdür.

Bu polimerin üretimi için başlangıç malzemesi, yaygın adı vinil klorür olan kloroetendir. Çünkü bu doymamış ikame maddesine vinil denir. Plastik ürünlerde sıklıkla karşılaşılan kısaltma olan PVC, polivinil klorür anlamına gelir.
Çift bağ ekleme reaksiyonlarını temsil eden beş özelliği tartıştık. Şimdi tepkilere bakalım oksidasyon.
Alken oksidasyon reaksiyonları
Altıncı içimizdeki kimyasal özellik genel liste Bu hafif bir oksidasyon veya Wagner reaksiyonudur. Bir alkene maruz kaldığında ortaya çıkar sulu çözelti soğukta potasyum permanganat olduğundan sınav görevlerinde genellikle sıfır derecenin sıcaklığı gösterilir.
Sonuç, dihidrik bir alkoldür. Bu durumda etilen glikol, ancak genel olarak bu tür alkoller yaygın isim glikoller Reaksiyon sırasında mor-pembe permanganat çözeltisinin rengi bozulur, dolayısıyla bu reaksiyon aynı zamanda çift bağ için nitelikseldir. Nötr bir ortamda manganez oksidasyon durumu +7'den oksidasyon durumu +4'e indirgenir. Birkaç örneğe daha bakalım. DENKLEM
Burada propandiol-1,2 elde ediyoruz. Ancak siklik alkenler de aynı şekilde reaksiyona girecektir. DENKLEM
Diğer bir seçenek ise çift bağın örneğin aromatik hidrokarbonların yan zincirinde yer almasıdır. Düzenli olarak sınav ödevleri Stiren içeren bir Wagner reaksiyonu var, ikinci adı vinilbenzen.

Umarım bir çift bağın hafif oksidasyonunun her zaman oldukça uyumlu olduğunu anlamanız için yeterli örnek vermişimdir. basit kural Pi bağı kırılır ve her karbon atomuna bir hidroksi grubu eklenir.
Şimdi sert oksidasyonla ilgili. Bizim olacak yedinci mülk. Bu oksidasyon, bir alken ısıtıldığında asidik bir potasyum permanganat çözeltisi ile reaksiyona girdiğinde meydana gelir.
Molekülün yıkımı, yani çift bağda yıkımı meydana gelir. Buten-2 durumunda iki molekül asetik asit elde edildi. Genel olarak karbon zincirindeki çoklu bağın konumu oksidasyon ürünlerinden değerlendirilebilir.
Buten-1'in oksidasyonu, bir propiyonik (propanoik) asit ve karbondioksit molekülü üretir.
Etilen durumunda iki molekül karbondioksit elde edersiniz. Her durumda, asidik bir ortamda manganez oksidasyon durumu +7'den +2'ye indirgenir.
Ve sonunda sekizinci mülk tam oksidasyon veya yanıyor.
Alkenler diğer hidrokarbonlar gibi yanarak karbondioksit ve suya dönüşür. Alkenlerin yanma denklemini genel biçimde yazalım.
CO2 molekülü bir karbon atomu içerdiğinden, alken molekülünde karbon atomu sayısı kadar karbon dioksit molekülü olacaktır. Yani n CO2 molekülü. Hidrojen atomlarından iki kat daha az su molekülü, yani 2n/2, yani sadece n olacaktır.
Solda ve sağda aynı sayıda oksijen atomu vardır. Sağ tarafta 2n karbondioksit artı n su var, yani toplam 3n. Sol tarafta aynı sayıda oksijen atomu vardır, bu da molekülün iki kat daha az olduğu anlamına gelir, çünkü molekül iki atom içerir. Yani 3n/2 oksijen molekülü. 1,5n yazabilirsiniz.
Gözden geçirdik sekiz Alkenlerin kimyasal özellikleri.













