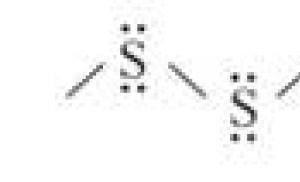Z akých atómov sa síra skladá? Všeobecná charakteristika síry
V skupine VIA je síra tiež široko známym a rozšíreným chemickým prvkom v prírode. V zemskej kôre sa síra nachádza vo forme množstva minerálov, ktoré tvoria bohaté ložiská. Často sa nachádza natívna síra, t.j. jednoduchá látka S (S 8). Zlúčeniny síry s kovmi sú veľmi bežné. Mnohé z nich sú najcennejšie ako rudy na výrobu kovov: olovnatý lesk PbS, zinková zmes ZnS, medený lesk CuS a pod. surovina na výrobu kyseliny sírovej.
Rozšírené sú aj niektoré sírany. Minerály sadra a anhydrit (kryštalický hydrát CaS0 4 2H 2 0 a bezvodý síran vápenatý) tvoria miestami celé pohoria. Síran horečnatý a sodný sa nachádza v morskej vode. Priehľadné kryštály tvorí síran strontnatý SrS0 4 - celestín. Baryt alebo ťažký špár BaS0 4 sa široko používa na výrobu bielej a ako plnivo v papierenskom a gumárenskom priemysle. Napríklad na fotografický papier sa nanesie vrstva barytu. Uhlie obsahuje značné množstvo síry a pri spaľovaní sa dostáva do atmosféry. Oxid cepbi(IV) S0 2 je neustále prítomný vo vzduchu. Ak by sa táto síra extrahovala z produktov spaľovania uhlia, bolo by možné výrazne znížiť produkciu tradičných sírnych rúd. Zároveň by sa znížili škodlivé účinky S0 2 na vegetáciu a sladkovodné útvary. Síra je vždy prítomná v proteínoch, pretože aminokyseliny cysteín a metionín obsahujú síru. Celková hmotnosť síry v ľudskom tele je 120 g.
Svetová produkcia síry presahuje 60 miliónov ton, z čoho viac ako polovica sa používa na výrobu kyseliny sírovej a zvyšok na výrobu siričitanov, kaučuku a produktov na ničenie škodcov v poľnohospodárstve.
Prírodná síra pozostáva zo štyroch stabilných izotopov, pričom 95 % tejto zmesi tvorí izotop
Pokiaľ ide o chemické vlastnosti, síra nevykazuje významné podobnosti s kyslíkom. Hlavná vec, ktorá spája tieto dva prvky, je dvojmocný stav v zlúčeninách s väčšinou chemických prvkov. Treba poznamenať, že v zlúčeninách medzi kyslíkom a sírou zostáva kyslík dvojmocný a síra môže byť štvor- alebo šesťmocná. V dôsledku prítomnosti sú možné vyššie valenčné stavy síry
zadarmo 3
Jednou z dôležitých a charakteristických vlastností atómov síry je schopnosť vytvárať reťazce:

Ak sú atómy kyslíka spojené do reťazcov s viac ako tromi atómami (v molekule ozónu), potom síra za určitých podmienok dáva reťazce stoviek tisíc atómov. Dva vzájomne prepojené atómy síry -8-8- často slúžia ako mostík v molekule proteínu.
Síra. Jednoduché látky
Síra ako jednoduchá látka tvorí niekoľko odrôd. Síra obyčajná je žltá, kryštalická, krehká látka tzv rombická síra. Krásne kryštály prírodnej síry sa nachádzajú v miestach, kde vystupujú sopečné plyny (Kamčatka, Kurilské ostrovy). Kosoštvorcová síra, stabilná za normálnych podmienok, sa topí pri 112,8 °C. Ale kvapalná síra pri 119 ° C začína kryštalizovať vo forme tmavo žltých ihličkovitých kryštálov monoklinického systému. Síra teda tvorí dve rôzne tuhé fázy, ale ortorombická síra pod 112,8 °C je stabilná. Teplota varu síry je 444,6 °C. Síra je nerozpustná vo vode, ale rozpustná v sírouhlíku a benzéne.
Pevná síra a jej roztoky pozostávajú z molekúl 8 8 . Sú to kruhové molekuly v tvare koruny (obr. 19.3).

Ryža. 19.3.
Pri písaní chemických reakcií sa molekulárna štruktúra síry zvyčajne neberie do úvahy a zapisuje sa vo forme atómov. Nad teplotou topenia síra postupne tmavne a pri ~250°C sa mení na viskóznu hmotu červenohnedej farby, pozostávajúcu z veľmi dlhých reťazcov 8R.
Nad 300 °C sa síra opäť stáva pohyblivou kvapalinou. Varením síry vznikajú oranžovo-žlté pary. Síra para obsahuje molekuly B 8, 5 b, 8 4 a $ 2. Molekuly 5 2 sú svojou štruktúrou blízke molekulám kyslíka 0 2.
Ak sa roztavená síra, zahriata do varu, vleje do studenej vody (obr. 19.4), zmení sa na hnedú, mäkkú, gumovitú hmotu, ktorá sa tiahne do nití. Tento typ síry sa nazýva plastová šedá. Pozostáva z cik-cak veľmi dlhých molekúl B, kde P dosiahne 100 000 alebo viac. Plastová síra po krátkom čase krehne, získava žltú farbu a postupne sa mení na kosoštvorcovú síru 5 8 .

Ryža. 19.4.
Síra sa získava priamo z prírodných ložísk. Vyťažená síra sa destiluje na čistenie v špeciálnych rafinačných peciach. Po prvé, para síry vstúpi do veľkej tehlovej komory. Na studených stenách sa síra zráža vo forme svetložltého prášku známeho ako sírová farba. Na horúcich stenách pri teplote asi 120°C sa síra mení na kvapalinu, ktorá sa uvoľňuje do drevených foriem, kde tvrdne vo forme tyčiniek. Takto získaná síra je tzv Čerenková.
Je tiež známych veľa reakcií, pri ktorých sa síra uvoľňuje z komplexných látok. Síra vzniká zmiešaním plynného sírovodíka a seiónového plynu:
Spaľovanie sírovodíka v podmienkach nedostatku kyslíka vedie aj k tvorbe síry (pozri nižšie).
Oxidy síry (IU) a uhlíka (H) reagujú a uvoľňujú síru v prítomnosti katalyzátora:
Táto reakcia sa používa na čistenie produktov spaľovania paliva od nečistôt síry.
Síra sa môže získať reakciou vo vodnom roztoku. Keď sa k roztoku tiosíranu sodného Na 2 5 2 0 3 pridá kyselina chlorovodíková, kvapalina sa zakalí a postupne sa vyzráža svetložltá jemná síra:
K chemickým premenám síry dochádza najmä pri zahrievaní. Bez účasti iných činidiel tvorí síra množstvo rôznych molekúl:
Síra sa kombinuje s takmer všetkými nekovmi a kovmi. Reakcia; vodík reverzibilné:
![]()
Síra reaguje s halogénmi a vytvára zlúčeniny v dvoj- a štvormocnom stave. Až s fluórom v jeho nadbytku vzniká plynná stabilná zlúčenina BR 6 .
Vo vzduchu a kyslíku síra horí modrým plameňom:

Keď síra horí, teplota prekročí 800 °C, v dôsledku čoho sa rovnováha druhej reakcie výrazne posunie doľava a iba ~5 % síry sa premení na $0 3.
Síra reaguje s kovmi za veľkého uvoľňovania tepla. Keď sa zapáli zmes prášku síry a zinku, dôjde k jasnému záblesku. Biely sulfid zinočnatý vzniká:
Síra reaguje s niektorými ^-prvkami 5. a 6. periódy ľahšie ako kyslík. Striebro je odolné voči kyslíku, ale po zmiešaní so sírou bez zahrievania vytvára hnedý sulfid:
![]()
Síra reaguje s oxidmi, kyselinami a soľami, ktoré vykazujú silné oxidačné vlastnosti:

Pri zahrievaní alkalickým roztokom reaguje síra rovnako ako halogény, t.j. poruchy:
Atómy síry z jednoduchej látky sa môžu pripojiť k síre v niektorých zložitých látkach:
Vo výslednom polysulfid sodík obsahuje reťazce atómov síry so záporným nábojom na koncoch:

Roztok siričitanu sodného pri varení reaguje so sírou:
Výsledný bezfarebný roztok obsahuje soľ tiosíru kyseliny - tiosíran sodný.
Síra sa nachádza v skupine VIa periodickej tabuľky chemických prvkov D.I. Mendelejev.
Vonkajšia energetická hladina síry obsahuje 6 elektrónov, ktoré majú 3s 2 3p 4. V zlúčeninách s kovmi a vodíkom má síra negatívny oxidačný stav prvkov -2, v zlúčeninách s kyslíkom a inými aktívnymi nekovmi - pozitívny +2, +4, +6. Síra je typický nekov, v závislosti od typu premeny môže ísť o oxidačné činidlo a redukčné činidlo.
 Hľadanie síry v prírode
Hľadanie síry v prírode
Síra sa nachádza vo voľnej (natívnej) forme a vo viazanej forme.
Najdôležitejšie prírodné zlúčeniny síry:
FeS 2 - pyrit železa alebo pyrit,
ZnS - zmes zinku alebo sfalerit (wurtzit),
PbS - olovnatý lesk alebo galenit,
HgS - rumelka,
Sb 2 S 3 - stibnit.
Okrem toho je síra prítomná v rope, prírodnom uhlí, zemných plynoch a prírodných vodách (vo forme síranových iónov a určuje „trvalú“ tvrdosť sladkej vody). Vo vlasoch sa koncentruje životne dôležitý prvok pre vyššie organizmy, neoddeliteľná súčasť mnohých bielkovín.
Alotropické modifikácie síry
Alotropia- je to schopnosť toho istého prvku existovať v rôznych molekulárnych formách (molekuly obsahujú rôzny počet atómov toho istého prvku, napríklad O 2 a O 3, S 2 a S 8, P 2 a P 4 atď. ). 
Síra sa vyznačuje schopnosťou vytvárať stabilné reťazce a cykly atómov. Najstabilnejšie sú S8, ktoré tvoria ortorombickú a jednoklonnú síru. Toto je kryštalická síra - krehká žltá látka.
Otvorené reťazce majú plastickú síru, hnedú látku, ktorá sa získava prudkým ochladením roztavenej síry (plastová síra po niekoľkých hodinách skrehne, získa žltú farbu a postupne sa mení na kosoštvorec). 
1) kosoštvorcový - S 8
t°pl. = 113 °C; r = 2,07 g/cm3
Najstabilnejšia modifikácia.
2) monoklinické - tmavo žlté ihly
t°pl. = 119 °C; r = 1,96 g/cm3
Stabilný pri teplotách nad 96°C; za normálnych podmienok sa mení na kosoštvorcový.
3) plast - hnedá gumovitá (amorfná) hmota
Nestabilný, pri tuhnutí sa mení na kosoštvorec
Získanie síry
- Priemyselná metóda je tavenie rudy pomocou pary.
- Neúplná oxidácia sírovodíka (s nedostatkom kyslíka):
2H2S + 02 -> 2S + 2H20
- Wackenroederova reakcia:
2H2S + S02 -> 3S + 2H20
Chemické vlastnosti síry
Oxidačné vlastnosti síry
(S 0
+ 2 ē→ S -2
)
1) Síra reaguje s alkalickými látkami bez zahrievania:
S + O2 – t° → S+402
2S + 302 – t °; pt → 2S +6 O 3
4) (okrem jódu):
S+Cl2 → S + 2 Cl 2
S + 3F 2 → SF 6
S komplexnými látkami:
5) s kyselinami - oxidačnými činidlami:
S + 2H2S04 (konc) → 3S + 402 + 2H20
S+6HNO3(konc) → H2S + 604 + 6N02 + 2H20
Disproporčné reakcie:
6) 3S0 + 6KOH → K2S +403 + 2K2S-2 + 3H20
7) síra sa rozpúšťa v koncentrovanom roztoku siričitanu sodného:
S 0 + Na 2 S + 4 O 3 → Na 2 S 2 O 3 tiosíran sodný


Síra a jej zlúčeniny patria medzi najdôležitejšie triedy pesticídov.
Síra je žltá pevná látka. Existujú kryštalické a amorfné odrody. Síra sa nerozpúšťa vo vode, dobre sa rozpúšťa v sírouhlíku, anilíne, fenole, benzéne, benzíne a zle v alkohole a chloroforme. Pri zvýšených teplotách sa spája s kyslíkom, kovmi a mnohými nekovmi. Dostupné vo forme 80-90% zmáčacieho prášku, 70-75% koloidnej síry a mletej síry.
Mletá síra nerozpúšťa sa vo vode a je ňou slabo zmáčaný.
Koloidná síra Je dobre zmáčaný vodou a pri pretrepaní alebo miešaní vytvára pretrvávajúce zakalené suspenzie. Odparuje sa slabo a pomaly.
Vyrábané a prepravované v kovových a drevených sudoch; a tiež v papierových vreckách ošetrených vodeodolnou látkou. Pri skladovaní vo voľných nádobách koloidná síra vysychá, mení sa na hrudky a potom sa veľmi zle mieša s vodou.
V chove hospodárskych zvierat sa koloidná síra používa na boj proti psoroptóze hovädzieho dobytka tak, že sa zvieratá postriekajú 3 % vodnou suspenziou so spotrebou 3 – 4 litre na zviera, dvakrát, v intervale 7 – 10 dní.
Síra je málo toxická. Akútna otrava pri práci s ním je vylúčená. Dlhodobé vdychovanie však môže spôsobiť problémy s dýchaním.
Sírové odrezky- roztavená síra premenená na valcovitý tvar. Lit. Pri spaľovaní 1,4 g sa získa 1 liter oxidu siričitého. Antiparazitický účinok síry je spôsobený tvorbou oxidu siričitého, sírovodíka, kyslíka, v prítomnosti vlhkosti, zásad a organických zlúčenín. Síra v koncentrácii 5-8% pôsobí zmäkčujúco, keratoplasticky, protizápalovo a slabo proti zapareninám, vo vysokých koncentráciách vznikajú v dôsledku tvorby kyselín sírovej a sírovej dráždivé, vysušujúce a keratolytické účinky. Sírne odrezky sa používajú na liečbu zvierat trpiacich svrabom, trichofytózou, mikrosporiou, furunkulózou, seboreou, ekzémom, dermatitídou vo forme 10-30% čistenej sírovej masti alebo 5-10 a 20% zrážanej sírovej masti, ako aj vo forme mastnoty a prachu.
Na liečbu svrabu použite sírovú masť (síra 6 dielov, zelené mydlo - 8, uhličitan draselný - 1 a vazelína - 10 dielov).
Vyčistená síra- síra, zbavená všetkých nečistôt, sa vyrába v prášku v starostlivo uzavretých nádobách. Čistená síra má antiparazitický a protijedový účinok proti mnohým otravám. Používa sa vo všetkých prípadoch ako rezanie síry.
Vyzrážala sa síra- očistený od mnohých nečistôt. Lit. Pri horení vzniká oxid siričitý, ktorý má antiparazitárne a insekticídne účinky. Farmakodynamika a mechanizmus účinku sú rovnaké ako pri štiepení síry. Dostupné vo forme prášku, v dobre uzavretých nádobách.
Síran sodný- látka obsahujúca síru s antiparazitárnym účinkom. Mechanizmom účinku je tvorba oxidu siričitého a síry počas interakcie molekúl tiosíranu sodného s molekulou kyselín alebo solí kyselín, v dôsledku čoho sa redoxné procesy v parazitoch prudko menia.
Vyrába sa vo forme prášku, ktorý je potrebné skladovať v dobre uzavretej nádobe.
Ukážky- akaricídny liek, ktorý obsahuje síru a pomocné zložky. Je to svetlohnedá mast so slabým špecifickým zápachom. Liečivo sa vyrába v sklenených alebo plastových fľašiach s objemom 10, 15 a 20 ml. Ukážky skladujte pri teplote 0-25°C na mieste chránenom pred svetlom. Čas použiteľnosti - 2 roky od dátumu výroby.
Demos je účinný proti sarkoptoidným roztočom - pôvodcom psoroptického svrabu u králikov, otodektického svrabu u mäsožravcov, notoedróze u mačiek, ako aj proti pôvodcovi demodikózy u psov.
Droga má nízku toxicitu pre teplokrvné živočíchy, nepôsobí dráždivo ani senzibilizujúco.
Pri liečbe ušných svrabov u zvierat najprv dôkladne očistite ušnice od chrastov tampónom namočeným v gáforovom alkohole, potom do ušnice pomocou pipety vstreknite 1,5 – 3,0 ml dema a zľahka masírujte ušnicu na spodine. Ak sú postihnuté iné časti tela, liek sa vtiera do postihnutých oblastí pomocou vatového tampónu rýchlosťou 0,1 až 0,3 cm priľahlej zdravej kože.
Zvieratá s veľkými plochami kožných lézií sa liečia v 2 dávkach s intervalom 1 dňa, pričom sa liek aplikuje najskôr na jednu polovicu a potom na druhú polovicu postihnutého povrchu tela.
Plison(difenyldisulfid), C12H10S2. Získava sa zmiešaním uhoľného oleja 22-42%, difenylsulfidu 6-10%, emulgátora OP-7 (kalafuna) alebo OP-10 (neonol) - 15-20% a vody do 100%. Difenyldisulfid vzniká ako vedľajší produkt pri výrobe uhoľnodechtových fenolov.
Plizon je homogénna olejovitá kvapalina tmavej farby. Vodná emulzia tohto liečiva je stabilná počas 4 hodín pri teplote miestnosti. Liečivo je málo toxické, pri kožnej aplikácii je LD50 12 500 mg/kg. 0,5% plisonová emulzia (terapeutická koncentrácia) je ovcami dobre znášaná a nie je sprevádzaná zmenami v morfologickom obraze krvi. Plizone 2% spôsobuje zníženie aktivity cholínesterázy a alkalickej fosfatázy v prvý deň po zakúpení, bez prejavov klinických príznakov toxikózy.
Plizon, podľa výskumu O.D. Yanyshevsky et al., sa vylučuje z vnútorných orgánov a tkanív oviec liečených 0,5 % emulziou po 40 dňoch a z tuku po 65. U zvierat liečených 0,25 % emulziou plison difenyldisulfid vo vnútorných orgánoch chýbal a tkaniva po 20 dňoch. Na ovčej vlne pretrváva až 5 mesiacov v množstve 15,1 mg/kg. Nevylučuje sa do mlieka dojčiacich oviec.
Lepran- produkt obsahujúci síru zo spracovania benzotiofénuhoľného dechtu. Kvapalina je tmavohnedej farby s vôňou uhoľného oleja. Po zmiešaní s vodou tvorí lepran stabilnú svetlohnedú emulziu. Drogu tvorí benzotiofén - 10-14%, uhoľný olej 57-64, emulgátor 25-30 a voda do 100%. Lepran je málo toxický, jeho LD50 pri nákupe oviec je 14250 mg/kg. Kumulačný koeficient je viac ako 5,28, čo naznačuje slabé kumulatívne vlastnosti a nemá alergénne alebo dráždivé vlastnosti pre pokožku a sliznice. Pri ošetrovaní oviec (jednorazový nákup) 2% lepranovou emulziou (0,22% DDV) sa podľa výskumu B.A. Timofeev, liek nemá mutagénne vlastnosti, nemení hematologické parametre fosfatázy, veterinárne a hygienické ukazovatele kvality ovčieho mäsa. 50 dní po ošetrení sa v orgánoch a tkanivách oviec nezistí benzotiofén, mäso je vhodné na uvoľnenie a predaj na potravinárske účely. Benzotiofén sa nevylučuje do mlieka, liek sa môže použiť na liečbu gravidných a laktujúcich oviec.
V prípade otravy zvierat liekmi obsahujúcimi síru sa vnútorne používa aktívne uhlie, spálená magnézia a preháňadlo.
Síra je chemický prvok nachádzajúci sa v periodickej tabuľke Mendelejeva na čísle 16 a je označený symbolom S (z latinského síra). Elementárnu povahu síry stanovil v roku 1777 francúzsky vedec a chemik Antoine Lavoisier. Síra vrie pri teplote 444 stupňov Celzia. Pri tavení prechádza z tuhého do kvapalného skupenstva, pričom postupne mení svoju farbu v závislosti od gradácie teploty tavenia. Napríklad pri dosiahnutí 160 stupňov Celzia tento chemický prvok zmení svoju farbu zo žltej na hnedú a pri zahriatí na 190 stupňov sa farba zmení na tmavo hnedú. Po dosiahnutí teploty 190 stupňov stráca síra svoju štrukturálnu viskozitu a postupne sa stáva tekutejšou. Prvok sa nakoniec stane tekutým, keď sa zahreje na 300 stupňov.
Okrem schopnosti premeny z pevnej látky na kvapalnú má síra množstvo ďalších zaujímavých vlastností. Má teda negatívnu tepelnú vodivosť a vôbec nevedie elektrický prúd. Je absolútne nerozpustný vo vode, ale je dokonale rozpustný v kvapalinách, ktoré nemajú vo svojej štruktúre molekuly vody (napríklad amoniak). Dobre interaguje s rozpúšťadlami a sírouhlíkom, ktoré sa vyznačujú organickou povahou. K popisu síry môžete pridať aj jej chemickú kôru. Síra je svojou povahou aktívna a pri zahriatí akýmkoľvek chemickým prvkom môže ľahko vstúpiť do chemickej reakcie. Môže interagovať s látkami, ako sú:
- – pri izbovej teplote s ním reaguje;
- s kovmi – vytvára sulfidy a je zároveň oxidačným činidlom;
- kyslík - zahrievanie na teplotu 280 stupňov Celzia, vytvára zlúčeniny oxidov;
- fluór - v tandeme s touto látkou sa síra prejavuje ako redukčné činidlo;
- fosfor alebo uhlík - pri absencii prívodu vzduchu sa síra prejavuje ako oxidačné činidlo.
Historické informácie
Chemický prvok síra vo svojom pôvodnom stave alebo vo forme zlúčenín síry poznalo ľudstvo už pred mnohými tisíckami rokov. Jeho jedinečné vlastnosti sa spomínajú nielen na posvätných stránkach Biblie a Tóry, ale aj v Homérových básňach a iných zdrojoch. Vďaka svojim vlastnostiam sa síra používala pri všetkých druhoch rituálov a náboženských obradov. Síra bola jednou z dôležitých súčastí „posvätného“ kadidla, ktoré sa používalo tak na vyháňanie duchov, ako aj na ich vyvolávanie. Používal sa na „omámenie tých, ktorí prišli“, pomocou síry v kombinácii s ortuťou; starí šamani verili, že v horiacom stave dokáže odpudzovať a vyháňať démonov, duchov a iných zlých duchov.
Síra sa stala neoddeliteľnou súčasťou pri vytváraní a používaní „gréckeho ohňa“, používaného pri vytváraní zápalných zmesí na vojenské účely. V Číne sa okolo 8. storočia používala síra ako pyrotechnika, jej presný vzorec bol zakázaný a jej distribúcia sa trestala smrťou.
Panoval názor, že hlavnými zložkami všetkých kovov sú síra (ako začiatok horľavosti) a ortuť (ako symbol začiatku metalickosti). Takáto hypotéza sa udiala v arabskej alchýmii.
Okrem toho Sera dlhodobo liečila kožné ochorenia, pričom túto metódu považovala za najúčinnejšiu v medicíne.
Aplikácia síry
Rozsah použitia síry je pomerne mnohostranný a rôznorodý. Primárne sa síra používa v chemickom priemysle na výrobu kyseliny sírovej; v poľnohospodárstve (vytvárať produkty, ktoré pomáhajú v boji proti škodcom a chorobám rastlín, hlavne hrozna a bavlny). Síra našla svoje uplatnenie aj pri výrobe kaučuku, používa sa pri výrobe zápaliek, je súčasťou farbív a luminiscenčných zlúčenín. V medicíne sa síra používa v bahenných kúpeľoch; takzvaná balneoterapia (z latinského „namočiť sa do vody“) – pomáha pri liečbe artritídy a kožných chorôb. Nebolo to vedecky dokázané, ale síra sa používa aj na liečbu astmy, hoci mnohí vedci sa domnievajú, že práve sírne výpary môžu vyvolať výskyt ochorení dýchacích ciest.
Síra v potravinách
Produkty bohaté na síru zahŕňajú:
- egreš,
- hrozno,
- pekárenské výrobky,
- cesnak,
- špargľa,
- kapusta,
- chudé hovädzie mäso,
- kuracie vajcia,
- mliečne výrobky,
- obilniny atď.
Nedostatok síry v tele
Nedostatok síry v ľudskom tele (pri dennom príjme 4-6 mg) sa prejavuje vo forme chorôb ako:
- vypadávanie vlasov alebo úplná plešatosť,
- ochorenie obličiek,
- rôzne alergie,
- lámavosť a lámavosť vlasov,
- bolesť kĺbov,
- zápcha,
- lámavé nechty,
- tachykardia.
Zaujímavé a vzdelávacie fakty o síre
Síra je základným prvkom v ľudskom tele, pretože sa podieľa na štruktúre buniek, chrupavkového tkaniva a nervových vlákien. Tiež sa podieľa na metabolických procesoch. Ukazuje sa ako vynikajúci stabilizátor práce a koordinácie nervového systému. Síra vyrovnáva hladinu cukru v krvi, čo je veľmi užitočné pre ľudí trpiacich cukrovkou.
Síra znižuje bolesť kĺbov a chrupaviek, pomáha odstraňovať žlč. Pôsobí aj protizápalovo na organizmus a využíva sa na regeneráciu tkanív. Pomáha posilňovať svalové tkanivo rastúceho tela.
Samotná síra je bez zápachu, ale v kombinácii s inými zložkami vydáva zápach zhnitých vajec.
Ako vidíme, takáto na prvý pohľad nenápadná a obyčajná síra je pre svoje široké uplatnenie nenahraditeľnou súčasťou plnohodnotného ľudského života. Bez síry by náš život stratil svoje výhody, naše zdravie by nebolo také pevné.
Síra vo svojom pôvodnom stave, ako aj vo forme zlúčenín síry, je známa už od staroveku. Spomína sa v Biblii, Homérových básňach a iných. Síra bola súčasťou „posvätného“ kadidla počas náboženských obradov; Verilo sa, že vôňa horiacej síry odháňa zlých duchov. Síra bola dlho nevyhnutnou súčasťou zápalných zmesí na vojenské účely, napríklad „grécky oheň“ (10. storočie nášho letopočtu). Okolo 8. storočia Čína začala používať síru na pyrotechnické účely. Síra a jej zlúčeniny sa už dlho používajú na liečbu kožných ochorení. V období arabskej alchýmie vznikla hypotéza, podľa ktorej sa síra (začiatok horľavosti) a ortuť (začiatok kovovosti) považovali za zložky všetkých kovov. Elementárnu povahu síry stanovil A. L. Lavoisier a zaradil ju do zoznamu nekovových jednoduchých telies (1789). V roku 1822 objavil E. Mitscherlich alotropiu síry.
Distribúcia síry v prírode. Síra je veľmi bežný chemický prvok (klark 4,7·10 -2); Nachádza sa vo voľnom stave (natívna síra) a vo forme zlúčenín - sulfidov, polysulfidov, síranov. Voda morí a oceánov obsahuje síran sodný, horčík a vápenatý. Je známych viac ako 200 minerálov síry, ktoré vznikli počas endogénnych procesov. V biosfére sa tvorí viac ako 150 minerálov síry (hlavne síranov); rozšírené sú procesy oxidácie sulfidov na sírany, ktoré sa zase redukujú na sekundárny H2S a sulfidy. Tieto reakcie sa vyskytujú za účasti mikroorganizmov. Mnohé biosférické procesy vedú ku koncentrácii síry – hromadí sa v pôdnom humuse, uhlí, rope, moriach a oceánoch (8,9·10 -2 %), podzemných vodách, jazerách a slaných močiaroch. V íloch a bridliciach je 6-krát viac síry ako v zemskej kôre ako celku, v sadre - 200-krát, v podzemných síranových vodách - desaťkrát. Cyklus síry sa vyskytuje v biosfére: so zrážkami sa dostáva na kontinenty a s odtokom sa vracia do oceánu. Zdrojom síry v geologickej minulosti Zeme boli najmä produkty sopečných erupcií s obsahom SO 2 a H 2 S. Ekonomická činnosť človeka urýchlila migráciu síry; oxidácia sulfidu sa zintenzívnila.
Fyzikálne vlastnosti síry. Síra je pevná kryštalická látka, stabilná vo forme dvoch alotropných modifikácií. Kosoštvorcový α-S je citrónovožltej farby, hustota 2,07 g/cm3, bod topenia 112,8 °C, stabilný pod 95,6 °C; jednoklonný β-S medovožltej farby, hustota 1,96 g/cm 3, teplota topenia 119,3 °C, stabilná medzi 95,6 °C a teplotou topenia. Obe tieto formy sú tvorené osemčlennými cyklickými molekulami S8 s väzbovou energiou S-S 225,7 kJ/mol.
Pri tavení sa síra mení na pohyblivú žltú kvapalinu, ktorá nad 160 °C hnedne a pri asi 190 °C sa z nej stáva viskózna tmavohnedá hmota. Nad 190 °C sa viskozita znižuje a pri 300 °C sa síra opäť stáva tekutou. Je to spôsobené zmenou štruktúry molekúl: pri 160 °C sa krúžky S 8 začnú lámať a premieňajú sa na otvorené reťazce; ďalšie zahrievanie nad 190 °C znižuje priemernú dĺžku takýchto reťazcov.
Ak sa roztavená síra zahriata na 250-300 °C vleje do studenej vody tenkým prúdom, získa sa hnedo-žltá elastická hmota (plastová síra). V sírouhlíku sa rozpúšťa len čiastočne a v sedimente zanecháva sypký prášok. Modifikácia rozpustná v CS 2 sa nazýva λ-S a nerozpustná modifikácia sa nazýva μ-S. Pri izbovej teplote sa obe tieto modifikácie transformujú na stabilný, krehký α-S. t varu síry 444,6 °C (jeden zo štandardných bodov medzinárodnej teplotnej stupnice). V pare pri bode varu okrem molekúl S8 existujú aj S6, S4 a S2. Pri ďalšom zahrievaní sa veľké molekuly rozpadajú a pri 900 ° C zostáva iba S2, ktorý sa pri približne 1 500 ° C zreteľne rozdeľuje na atómy. Keď sa vysoko zahriata para síry zmrazí tekutým dusíkom, získa sa purpurová modifikácia tvorená molekulami S2, stabilná pod -80 °C.
Síra je zlý vodič tepla a elektriny. Je prakticky nerozpustný vo vode, rozpustný v bezvodom amoniaku, sírouhlíku a množstve organických rozpúšťadiel (fenol, benzén, dichlóretán a iné).
Chemické vlastnosti síry. Konfigurácia vonkajších elektrónov atómu S 3s 2 Зр 4. V zlúčeninách má síra oxidačné stavy -2, +4, +6. Síra je chemicky aktívna a obzvlášť ľahko sa spája pri zahrievaní s takmer všetkými prvkami, s výnimkou N 2, I 2, Au, Pt a inertných plynov. CO2 vo vzduchu nad 300 °C vytvára oxidy: SO2 - anhydrid siričitý a SO3 - anhydrid kyseliny sírovej, z ktorých sa získava kyselina sírová a kyselina sírová, ako aj ich soli, siričitany a sírany. Už v chlade sa S energeticky spája s F2, pri zahriatí reaguje s Cl2; s brómom tvorí síra len S 2 Br 2, jodidy síry sú nestabilné. Pri zahrievaní (150-200 °C) dochádza k reverzibilnej reakcii s H2 za vzniku sírovodíka. Síra tvorí aj polysírne vodíky všeobecného vzorca H 2 S X, takzvané sulfány. Sú známe mnohé organosírne zlúčeniny.
Pri zahrievaní síra reaguje s kovmi, pričom vznikajú zodpovedajúce zlúčeniny síry (sulfidy) a polysírne kovy (polysulfidy). Pri teplote 800 – 900 °C sírne výpary reagujú s uhlíkom za vzniku sírouhlíka CS 2. Zlúčeniny síry s dusíkom (N 4 S 4 a N 2 S 5) možno získať len nepriamo.
Získanie síry. Elementárna síra sa získava z prírodnej síry, ako aj oxidáciou sírovodíka a redukciou oxidu siričitého. Zdrojom sírovodíka na výrobu síry je koksárenský plyn, zemné plyny a plyny z krakovania ropy. Na spracovanie H2S boli vyvinuté mnohé metódy; Najdôležitejšie sú: 1) H2S sa extrahuje z plynov roztokom monohydrotioarzeničnanu sodného:
Na2HAsS202 + H2S = Na2HAsS30 + H20.
Potom fúkaním vzduchu cez roztok sa síra vyzráža vo voľnej forme:
NaHAsS30 + 1/202 = Na2HAsS202 + S.
2) H 2 S sa izoluje z plynov v koncentrovanej forme. Potom sa jeho objem oxiduje vzdušným kyslíkom na síru a čiastočne na SO2. Po ochladení H 2 S a vznikajúce plyny (SO 2, N 2, CO 2) vstupujú do dvoch sekvenčných konvertorov, kde v prítomnosti katalyzátora (aktivovaný bauxit alebo špeciálne vyrobený hliníkový gél) prebieha reakcia:
2H2S + S02 = 3S + 2H20.
Výroba síry z SO 2 je založená na reakcii jej redukcie s uhlím alebo prírodnými uhľovodíkovými plynmi. Niekedy sa táto výroba kombinuje so spracovaním pyritových rúd.
Odrody síry. Síra tavená priamo zo sírnych rúd sa nazýva prírodná hrudka; získané z H 2S a SO 2 - plynová hrudka. Prírodná hrudková síra, čistená destiláciou, sa nazýva rafinovaná.
Skondenzuje z pár pri teplote nad bodom topenia v kvapalnom stave a potom sa naleje do foriem - rezanie Sulfur. Keď síra kondenzuje pod bodom topenia, na stenách kondenzačných komôr sa vytvára jemný prášok síry - sírová farba. Obzvlášť vysoko rozptýlená síra sa nazýva koloidná.
Aplikácia síry. Síra sa používa predovšetkým na výrobu kyseliny sírovej; v papierenskom priemysle (na výrobu sulfitu celulózy); v poľnohospodárstve (na boj proti chorobám rastlín, najmä hrozna a bavlny); v gumárenskom priemysle (vulkanizačné činidlo); pri výrobe farbív a svetelných kompozícií; získať čierny (poľovnícky) prášok; pri výrobe zápaliek.
Síra v tele. Vo forme organických a anorganických zlúčenín je síra neustále prítomná vo všetkých živých organizmoch a je dôležitým biogénnym prvkom. Jeho priemerný obsah na sušinu je: v morských rastlinách asi 1,2%, suchozemských - 0,3%, v morských živočíchoch 0,5-2%, suchozemských - 0,5%. Biologická úloha síry je daná tým, že je súčasťou zlúčenín rozšírených v živej prírode: aminokyselín (metionín, cysteín), a teda proteínov a peptidov; koenzýmy (koenzým A, kyselina lipoová), vitamíny (biotín, tiamín), glutatión a iné. Sulfhydrylové skupiny (-SH) cysteínových zvyškov hrajú dôležitú úlohu v štruktúre a katalytickej aktivite mnohých enzýmov. Vytváraním disulfidových väzieb (-S-S-) v rámci jednotlivých polypeptidových reťazcov a medzi nimi sa tieto skupiny podieľajú na udržiavaní priestorovej štruktúry molekúl proteínov. U zvierat sa Síra nachádza aj vo forme organických sulfátov a sulfónových kyselín - kyselina chondroitínsírová (v chrupavkách a kostiach), kyselina taurocholová (v žlči), heparín, taurín. V niektorých proteínoch obsahujúcich železo (napríklad ferodoxíny) sa síra nachádza vo forme sulfidu labilného v kyslom prostredí. Síra je schopná vytvárať energeticky bohaté väzby vo vysokoenergetických zlúčeninách.
Anorganické zlúčeniny síry sa v organizmoch vyšších živočíchov nachádzajú v malom množstve najmä vo forme síranov (v krvi, moči), ako aj tiokyanáty (v slinách, žalúdočnej šťave, mlieku, moči). Morské organizmy sú bohatšie na anorganické zlúčeniny síry ako sladkovodné a suchozemské. Pre rastliny a mnohé mikroorganizmy slúži síran (SO 4 2-) spolu s fosforečnanom a dusičnanom ako najdôležitejší zdroj minerálnej výživy. Pred začlenením do organických zlúčenín síra prechádza zmenou mocenstva a potom sa premieňa na organickú formu vo svojom najmenej oxidovanom stave; Síra sa teda široko podieľa na redoxných reakciách v bunkách.
V bunkách sa sulfáty, ktoré interagujú s adenozíntrifosfátom (ATP), premieňajú na aktívnu formu - adenylylsulfát.
Enzým, ktorý katalyzuje túto reakciu, sulfuryláza (ATP: sulfát-adenylyltransferáza), je v prírode rozšírený. V tejto aktivovanej forme prechádza sulfonylová skupina ďalšími premenami - je prenesená na iný akceptor alebo redukovaná.
Zvieratá asimilujú síru ako súčasť organických zlúčenín. Autotrofné organizmy získavajú všetku síru obsiahnutú vo svojich bunkách z anorganických zlúčenín, najmä vo forme síranov. Vyššie rastliny, mnohé riasy, huby a baktérie majú schopnosť autotrofne asimilovať síru. (Z bakteriálnej kultúry bol izolovaný špeciálny proteín, ktorý transportuje sulfát cez bunkovú membránu z prostredia do bunky.) V kolobehu síry v prírode hrajú hlavnú úlohu mikroorganizmy – odsírujúce baktérie a sírne baktérie. Mnohé rozvinuté ložiská síry sú biogénneho pôvodu. Síra je súčasťou antibiotík (penicilíny, cefalosporíny); jeho zlúčeniny sa používajú ako rádioprotektívne prostriedky a prostriedky na ochranu rastlín.